
【题目】下列有机物中,不能与溴水反应而使其褪色,但能使酸性KMnO4溶液褪色,且苯环上的一氯代物只有3种的是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
科目:高中化学 来源: 题型:
【题目】![]() 是火箭的固体燃料,发生反应为
是火箭的固体燃料,发生反应为![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.![]() 溶于水电离方程式为
溶于水电离方程式为![]()
B.反应中还原产物分子数与氧化产物分子总数之比为1∶3
C.产生![]() 反应转移的电子总数为
反应转移的电子总数为![]()
D.![]() 分解产生的气体体积为44.8L
分解产生的气体体积为44.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将4molA(g)和2molB(g)充入2L恒容密闭容器中,发生2A(g)+B(g) ![]() 2C(g),一段时间达到平衡,反应过程中测定的数据如下表。下列说法正确的是
2C(g),一段时间达到平衡,反应过程中测定的数据如下表。下列说法正确的是
t/min | 2 | 4 | 8 | 9 |
n(B)/mol | 1.5 | 1.2 | 1.0 | 1.0 |
A.该温度下反应的平衡常数K=1.0
B.反应0~4 min的平均速率υ(C)=0.4 molL﹣1min﹣1
C.其他条件不变,升高温度反应的平衡常数增大,则该反应为吸热反应
D.其他条件不变,再充入4molA(g),达到新平衡时A的浓度减小,B的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在生产生活中有广泛的应用。
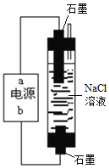
(1)一种环保型家用“84”消毒液的发生装置如右图,电源的b极为________极,电解制取NaClO的离子反应方程式为_______。
(2)用CO和Cl2在高温、活性炭催化作用下合成光气:Cl2(g)+CO(g) ![]() COCl2(g) H=-108 kJ·mol-1。t℃时,在5 L恒容密闭容器中加入0.6 mol CO和0.45 mol Cl2,CO和COCl2的浓度在不同时刻的变化状况如图所示。
COCl2(g) H=-108 kJ·mol-1。t℃时,在5 L恒容密闭容器中加入0.6 mol CO和0.45 mol Cl2,CO和COCl2的浓度在不同时刻的变化状况如图所示。
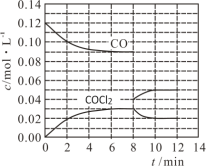
在0~6 min内υ(Cl2)=____________________,第8 min时改变的条件是________________。在第12 min时升高温度,重新达到平衡时,COCl2的体积分数将________(填“增大”“不变”或“减小”)。
(3)氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气——氯水体系中存在以下平衡关系:
![]() Cl2(g)
Cl2(g) ![]()
![]() Cl2(aq) K1=10-0.6
Cl2(aq) K1=10-0.6
Cl2(aq) + H2O![]() HClO + H+ +Cl- K2=10-3.4
HClO + H+ +Cl- K2=10-3.4
HClO ![]() H+ + ClO- Ka
H+ + ClO- Ka
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
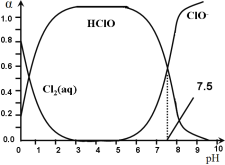
则①Ka = __________;
②Cl2(g) + H2O ![]() HClO + H+ +Cl- K = __________;
HClO + H+ +Cl- K = __________;
③用氯处理饮用水时,pH=6.5时杀菌效果比pH=7.5时___(填“好”、“差”或“相同”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.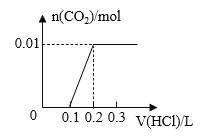 B.
B.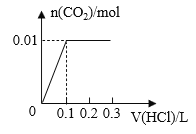
C.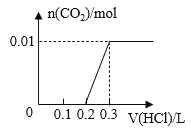 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰(CN)2、硫氰(SCN)2等称为拟卤素,它们与卤素单质性质相似,它们的阴离子也与卤素阴离子性质相似。例如:2Fe+3(SCN)2==2Fe(SCN)3、Ag++CN-== AgCN↓(白)。拟卤素形成的无氧酸和含氧酸一般比氢卤酸和次卤酸弱,阴离子的还原性一般比Br-强。下列反应中,不正确的是( )
A. 2CN-+Cl2= 2Cl-+(CN)2
B. (CN)2+2OH-=CN-+CNO-+H2O
C. (SCN)2+H2O = 2H++SCN-+SCNO-
D. MnO2+4HSCN(浓)![]() (SCN)2↑+Mn(SCN)2+2H2O
(SCN)2↑+Mn(SCN)2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是__________。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________、________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_______________。
②E处干燥管中盛放的药品是碱石灰,其作用是_____________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量_____________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:
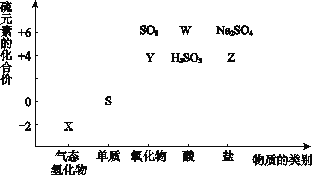
(1)Y的化学式为_________,检验Y所用的试剂是________________。
(2)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为__________________。
(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是_______(填序号)。
a.Na2S + S b.Na2SO3 + S c.Na2SO3 + Na2SO4d.SO2 + Na2SO4
(4)将X与SO2混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有的阳离子为H+、Na+、Mg2+、Al3+、Ba2+中的一种或几种,向该溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此确定原溶液中一定含有的阳离子是
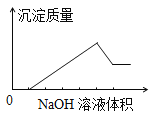
A. Mg2+、Al3+、Na+ B. H+、Mg2+、Al3+ C. H+、Ba2+、Al3+ D. Ba2+、Mg2+、Al3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com