
科目: 来源: 题型:
【题目】向MgCl2、AlCl3的混合溶液中,开始滴加试剂X,之后改滴试剂Y,所得沉淀的物质的量n(mol)与试剂体积V(mL)间的关系如图所示。以下结论错误的是( )
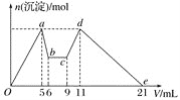
A.X是盐酸,Y是NaOH溶液,且c(Y)=2c(X)
B.原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl-)=1∶1∶5
C.X是NaOH溶液,Y是盐酸,且c(NaOH)∶c(HCl)=2∶1
D.从b至c相应的离子方程式为H++OH-===H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2=NH4BO2+4H2O。已知两极室中电解质足量,下列说法正确的是( )
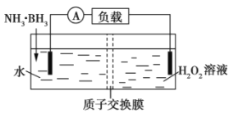
A.正极的电极反应式为2H++2e-═H2↑
B.电池工作时,H+通过质子交换膜向负极移动
C.电池工作时,正、负极分别放出H2和NH3
D.工作一段时间后,若左右两极室质量差为1.9g,则电路中转移0.6mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1) 200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。(2) 向(1)的滤液中加入足量的NaOH溶液,加热,标准状况下产生能使湿润红色石蕊试纸变蓝的气体1.12 L。由此可以得出关于原溶液组成的正确结论是
A. 一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+
B. 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+
C. c(CO32-)=0.01mol·L-1,c(NH4+)>c(SO42-)
D. 如果上述6种离子都存在,则c(Cl-)>c(SO42-)
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾是一种新型、高效、多功能水处理剂,工业上采用向KOH溶液中通入氯气,然后再加入![]() 溶液的方法制备
溶液的方法制备![]() ,发生反应:
,发生反应:
①![]() (未配平);
(未配平);
②![]() 。
。
下列说法正确的是
A.若反应①中![]() ,则氧化剂与还原剂的物质的量之比为2:1
,则氧化剂与还原剂的物质的量之比为2:1
B.反应①中每消耗4 mol KOH,吸收标准状况下![]()
C.氧化性:![]()
D.若反应①的氧化产物只有KClO,则得到![]() 时消耗
时消耗![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )
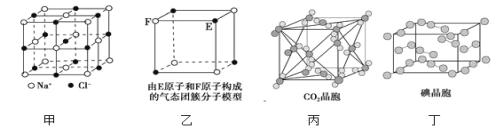
A.在NaCl晶体(图甲)中,距Na+最近的C1-围成正八面体
B.该气态团簇分子(图乙)的分子式为EF或FE
C.在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻
D.在碘晶体(图丁)中,存在的作用力有非极性共价键和范德华力
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是

A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中n(NH4+)=0.2 mol
C.溶液中一定不含CO32-,可能含有SO42-和NO3-
D.n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色溶液中含有的阳离子为H+、Na+、Mg2+、Al3+、Ba2+中的一种或几种,向该溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此确定原溶液中一定含有的阳离子是
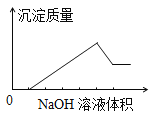
A. Mg2+、Al3+、Na+ B. H+、Mg2+、Al3+ C. H+、Ba2+、Al3+ D. Ba2+、Mg2+、Al3+
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加徳罗常数的值,下列说法正确的是
A.常温下,1L pH=13的Ba(OH)2溶液中OH-数目为0.2NA
B.在电解精炼粗铜的过程中,当阴极质量增重32 g时转移电子数目为NA
C.常温常压下,1 mol分子式为C2H6O的有机物中,含有C—O键的数目为NA
D.氢氧燃料电池正极消耗22.4L气体时,负极消耗的气体分子数目为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是实验室制氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
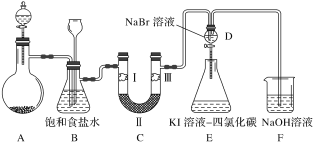
(1)制备氯气选用的药品为二氧化锰和浓盐酸,则相关的化学反应方程式为:_____。
(2)装置B中饱和食盐水的作用是___________ 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ应依次放入_____。(填字母)
a | b | c | d | |
Ⅰ | 干燥的 有色布条 | 湿润的 有色布条 | 湿润的 有色布条 | 干燥的 有色布条 |
Ⅱ | 碱石灰 | 无水CaCl2 | 浓硫酸 | 无水CaCl2 |
Ⅲ | 湿润的 有色布条 | 干燥的 有色布条 | 干燥的 有色布条 | 湿润的 有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为橙黄色,打开D装置中活塞,将D中少量溶液加入装置E中,振荡。观察到的现象是_________。经认真考虑,有同学提出该实验方案仍有不足,请说明其中原因___________。
(5)装置F中用足量NaOH溶液吸收剩余的氯气,试写出相应的化学方程式:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法正确的是( )

A. 电极b反应式是O2+4e-+2H2O=4OH-
B. 电解后乙装置d电极附近溶液的pH不变
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 甲中每消耗1mol SO2,乙装置中有1mol H+通过隔膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com