
����Ŀ����MgCl2��AlCl3�Ļ����Һ�У���ʼ�μ��Լ�X��֮��ĵ��Լ�Y�����ó��������ʵ���n(mol)���Լ����V(mL)��Ĺ�ϵ��ͼ��ʾ�����½��۴������(����)
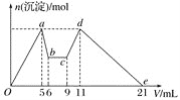
A.X�����ᣬY��NaOH��Һ����c(Y)��2c(X)
B.ԭ���Һ�У�c(Al3��)��c(Mg2��)��c(Cl��)��1��1��5
C.X��NaOH��Һ��Y�����ᣬ��c(NaOH)��c(HCl)��2��1
D.��b��c��Ӧ�����ӷ���ʽΪH����OH��===H2O
���𰸡�A
��������
����ͼ���֪�ȼ�����Լ�Xһ��ʼ�Ͳ��������������Լ��ļ�����������ܽ⣬�����Լ�XΪNaOH������������Լ�Y������������������������ļӦ���������Լ�Y��������������ƫ���������ᷴӦ���ɳ���������������ƫ������ȫ��ת��Ϊ�����������ٵ����ᣬ���ܽ�������������������þ�������Լ�YΪ���ᡣ
A. �������Ϸ�����֪X���������ƣ�Y�����ᣬ��A����
B. ���������Ƶ�Ũ��Ϊ6mol/l���Ӽ���5mLX���ɳ�����࣬�ټ�����1mLX���������ٵ���Сֵ���μ�����������5��6��1 mL��ʱ��Ӧ��Ӧ�����ӷ���ʽΪ��Al��OH��3��+NaOH=NaAlO2+2H2O���ɴ˿�֪��n��Al3+��=n[Al��OH��3]=0.006mol����ǰ5mLNaOH�γ�����������֪��2n��Mg2+��+3n��Al3+��=0.03mol������n��Mg2+��=0.006mol����Һ�������������������ȣ���n��Cl-��=0.03mol������Һ��c(Al3��)��c(Mg2��)��c(Cl��)��1��1��5����B��ȷ��
C. ��ͼ��֪��5��6��1mL��Ϊ�����������ܽ⣬������Ӧ��Al��OH��3+NaOH=NaAlO2+2H2O��9��11��2 mL��Ϊƫ������ǡ����ȫ����Al��OH��3������������Ӧ��NaAlO2+HCl+H2O=Al��OH��3��+NaCl��������Ԫ���غ�֪��NaOH��Al��OH��3��AlO2-��H+�ɴ˿����Ƴ���n��NaOH��=n��HCl������Ϊv��NaOH����v��HCl��=1��2�����ԣ�c��NaOH����c��HCl��=2��1����C��ȷ��
D. ��6mL����ԭ���ĵμ�NaOH����Ϊ�μ����ᣬ��ͼ��֪7mL��9mLʱ��ӦҺ���г��������䣬������֪��ʱ������������кͷ�Ӧ����H����OH��===H2O����D��ȷ��
��ĿҪ��ѡ����ģ���ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�ֳ�Ӳ��ĥͿ����ϣ���ͼΪ�侧�������е�ÿ��ԭ�Ӿ�����8�����ȶ��ṹ��
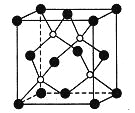
�����й�˵����ȷ���ǣ� ��
A. ��������۵�ܵ�
B. ������Ļ�ѧʽΪBP���������Ӿ���
C. ��������ÿ��ԭ�Ӿ��γ�4�����ۼ�
D. ������ṹ�����Ŀռ�ѻ���ʽ���Ȼ�����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�ּ��߷�չDZ���������Դ����̫����Ϊ��Դ���Ȼ�ѧ���ѭ���ֽ�ˮ��һ�ָ�Ч������Ⱦ�����ⷽ�����䷴Ӧ������ͼ��ʾ��

��1����ӦI�Ļ�ѧ����ʽ��____________________��
��2����ӦI�õ��IJ�����I2���з��룮�ò������Һ�ڹ���I2�Ĵ����»�ֳ����㣭����Ũ��I2��H2SO4��ͺ���Ũ��I2��HI�㡣
�ٸ���������ʵ������˵����ȷ����__________��ѡ����ţ���
a��������Һ���ܶȴ��ڲ���
b����I2ǰ��H2SO4��Һ��HI��Һ������
c��I2��HI��Һ�б���H2SO4��Һ������
�ڱ��������Һ�ķ�����_______________________________��
�۾���⣬H2SO4����c��H+����c��SO42����=2.06��1�����ֵ����2��ԭ����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ����ɵĿ���A���ⶨA����ɼ���ȡ������D��������ͼ��
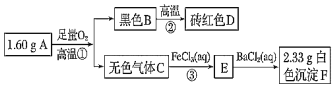
��ش�
��1��A�Ļ�ѧʽΪ______
��2��д���۵����ӷ���ʽ��______
��3��д��D��������ϡ����Ļ�ѧ����ʽ��______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̴���ͭʱ�����õĿ���ԭ����Ҫ�ǿ�ȸʯ����Ҫȼ����ľ̿�����¶�1000������ұ���������漰�ķ�Ӧ�У�
��Cu2(OH)2CO3![]() 2CuO+CO2��+H2O��
2CuO+CO2��+H2O��
��2CuO+C![]() 2Cu+CO2����
2Cu+CO2����
��CuO+CO![]() Cu+CO2��
Cu+CO2��
��CO2+C![]() 2CO��
2CO��
(1)�����ֻ�����Ӧ�����������٢ڢܵķ�Ӧ���ͷֱ�Ϊ��___________����___________����___________��
(2)��Ӧ���У�____________����������Ӧ��__________������ԭ��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��120����101.3 kPa�����飨CH4��������O2�Ļ����õ����ȼ��CH4+2O2=CO2+2H2O���ָ���ԭ�����¶Ⱥ�ѹǿ����÷�Ӧ�������ܶ�Ϊ��ͬ������H2�ܶȵ�15������ԭ��������м���������������Ϊ�� ��
A. 2��1B. 1��2C. 1��7D. 7��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ͪ��һ��ҽҩ�м��壬��ṹ��ʽ��ͼ��ʾ������˵����ȷ����(����)
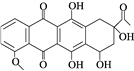
A. ÿ�����ͪ�����к���2������̼ԭ��
B. ���ͪ���������е�̼ԭ�Ӷ���ͬһ��ƽ����
C. 1 mol���ͪ������2 mol Br2����ȡ����Ӧ
D. һ�����������ͪ�ɷ����������ӳɡ���ȥ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β������Ҫ�ɷ���CO��SO2��NO��NO2�ȡ�
��1�����ð�ˮ���Խ�SO2��NO2���գ�ԭ������ͼ��ʾ��
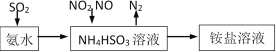
��д��NO2�����շ�Ӧ�����ӷ���ʽ___________________��
��2�����й�����Ŀǰ���ڳ����Զ�������(TiO2)���ֽ�����β�����о���
����֪����Ӧ��2NO(g)��O2(g)==2NO2(g) ��H1 ����113.0 kJ��mol��1
��Ӧ��2SO2(g)��O2(g)==2SO3(1) ��H2 ����288.4 kJ��mol��1
��Ӧ��3NO2(g)��H2O(g)==2HNO3��NO(g) ��H3 ����138.0 kJ��mol��1
��ӦNO2(g)��SO2(g)==NO(g)��SO3(1) ��H4= _______________��
����֪TiO2��β������ԭ���ɱ�ʾΪ��2CO(g)��O2(g) ![]() 2CO2(g) ��H5�� 2H2O(g)��4NO(g)��3O2(g)
2CO2(g) ��H5�� 2H2O(g)��4NO(g)��3O2(g) ![]() 4HNO3(g) ��H6��
4HNO3(g) ��H6��
��O2��H2O(g)Ũ��һ�������£�ģ��CO��NO�Ľ��⣬�õ��併���ʣ���ת���ʣ���ͼ��ʾ�������ts��NO�������½��Ŀ���ԭ��_____________________��
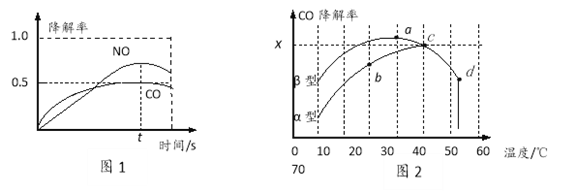
��3�����������Ҳ�ɽ���CO����ͼΪ�ڲ�ͬ������϶��������������������ͣ��ڲ�ͬ�¶��£���Ӧ��ͬʱ�䣬���CO�����ʱ仯�������ͼ�ش��������⣺
����֪��50��ʱ��������������������У�ƽ��ʱO2Ũ��Ϊ0.01mol��L��1������¶���CO���ⷴӦ��ƽ�ⳣ��_______________��
�����й�����ͼ��������ȷ����_________________
A����������b�㵽c�����¶ȵ����߶�����֪CO���ⷴӦ��ƽ�ⳣ��Kb��Kc
B����ͬ�¶������������������CO�������ʱ�����Ҫ��
C��d�㽵���ʳ���ͻ���ԭ��������¶����ߺ����ʧЧ
�ۿ����Ŷ��������������������Ϊ���壬��TiO2��Ϊ��Ч�����õ�TiO2���ܣ���10�桫60�淶Χ�ڽ���ʵ�飬������ͼ�����߶��롰![]() ����Ӱ����CO���������¶ȱ仯�����߿��ܳ��ֵ��������Χ_____________��
����Ӱ����CO���������¶ȱ仯�����߿��ܳ��ֵ��������Χ_____________��
��4��TiO2���ܵ��Ʊ�����������ˮ��Һ���Խ�����Ϊ�������е�⣬д�������ĵ缫��Ӧʽ ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ����0.200molL-1����ζ� 20.00mL 0.200 molL-1 �� NaY ��Һ����Һ��ˮ�ĵ���̶����������������仯��ͼ��ʾ�����Եζ���������Һ����仯�����������й�˵����ȷ���ǣ���֪ Ka(HY)=5.0��10-11]

A.��ѡȡ��̪��Ϊ�ζ�ָʾ��B.M ����Һ�� pH>7
C.Q ��ˮ�ĵ���̶���С��Kw<l0-14D.M�㣬c(Na+)=c (HY)+c (Y-)+c (Cl-)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com