
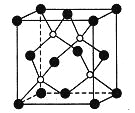
【题目】磷化硼是一种超硬耐磨涂层材料,右图为其晶胞,其中的每个原子均满足8电子稳定结构。
下列有关说法正确的是( )
A. 磷化硼晶体的熔点很低
B. 磷化硼晶体的化学式为BP,属于离子晶体
C. 磷化硼晶体中每个原子均形成4条共价键
D. 磷化硼晶体结构中微粒的空间堆积方式与氯化钠相同
【答案】C
【解析】
由图可知,白球位于体内,共有4个,而黑球位于顶点和面心,个数为8×![]() +6×
+6×![]() =4,化学式为BP,原子配位数为4,由信息可知磷化硼是一种超硬耐磨涂层材料,所以磷化硼为原子晶体。
=4,化学式为BP,原子配位数为4,由信息可知磷化硼是一种超硬耐磨涂层材料,所以磷化硼为原子晶体。
A. 由磷化硼是一种超硬耐磨涂层材料,说明磷化硼属于原子晶体,熔点高,故A错误;
B.在磷化硼晶胞中,白球位于体内,共有4个,黑球位于顶点和面心,个数为8×![]() +6×
+6×![]() =4,化学式为BP,磷化硼是一种超硬耐磨涂层材料,说明磷化硼属于原子晶体,故B错误;
=4,化学式为BP,磷化硼是一种超硬耐磨涂层材料,说明磷化硼属于原子晶体,故B错误;
C.该晶胞配位数为4,即每个原子均形成4条共价键,故C正确;
D.该晶胞中原子的配位数为4,而NaCl晶胞结构中阴阳离子的配位数均为6,所以磷化硼晶体结构中微粒的空间堆积方式与氯化钠不相同,故D错误;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法不正确的是
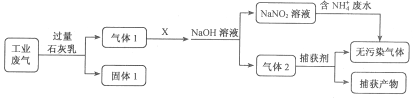
A. 固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B. X可以是空气,且需过量
C. 捕获剂所捕获的气体主要是CO
D. 处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-==N2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某十钒酸铵[(NH4)xH6-xV10O28·yH2O(其中钒为+5价)]常用来制造高端钒铝合金。
Ⅰ. (NH4)xH6-xV10O28·yH2O的制备
将NH4VO3溶于pH为4的弱酸性介质后,加入乙醇,过滤得到(NH4)xH6-xV10O28·yH2O晶体。乙醇的作用是____________________________________。
Ⅱ. (NH4)xH6-xV10O28·yH2O的组成测定
(1) NH4+含量测定
准确称取0.363 6 g该十钒酸铵晶体,加入蒸馏水和NaOH溶液,加热煮沸,生成的氨气用20.00 mL 0.100 0 mol·L-1盐酸标准溶液吸收。用等浓度的NaOH标准溶液滴定过量盐酸,消耗NaOH标准溶液8.00 mL。
(2) V10O![]() (M=958 g·mol-1)含量测定
(M=958 g·mol-1)含量测定
步骤1:准确称取0.3636 g该十钒酸铵晶体,加入适量稀硫酸,微热使之溶解。
步骤2:加入蒸馏水和NaHSO3,充分搅拌,使V10O![]() 完全转化为VO2+。
完全转化为VO2+。
步骤3:加适量稀硫酸酸化,加热煮沸,除去溶液中+4价硫。
步骤4:用0.020 00 mol·L-1 KMnO4标准溶液滴定,终点时消耗30.00 mL KMnO4标准溶液(该过程中钒被氧化至+5价,锰被还原至+2价)。
①写出步骤2反应的离子方程式:____________________________________。
②若未进行步骤3操作,则数值y将________(填“偏大”“偏小”或“无影响”)。
③通过计算确定该十钒酸铵晶体的化学式(写出计算过程)。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法错误的是( )
A. 1 mol Cl2与过量Fe粉反应生成FeCl3,转移2NA个电子
B. 4.7 g核素![]() 发生裂变反应:
发生裂变反应:![]() +
+![]()
![]()
![]() +
+![]() +3
+3![]() ,净产生的中子(
,净产生的中子(![]() )数为0.06NA
)数为0.06NA
C. 1 mol Zn与一定量浓硫酸恰好完全反应,则生成的气体分子数为NA
D. 在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成1 mol Cl2转移的电子数为1.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
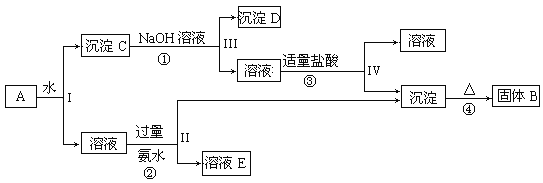
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是___________。
(2)写出①、②、③离子方程式④化学反应方程式
①____________________________;②___________________________;
③____________________________;④____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度氧化铝(Al2O3)的用途很广。实验室用(NH4)2SO4、H2O2、氨水、Al2(SO4)3为原料,通过以下过程制备Al2O3:
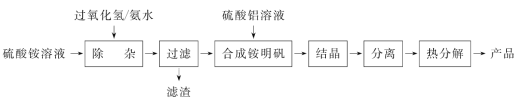
(1)“除杂”操作是加入H2O2后,用氨水调节溶液的pH约为3,以除去硫酸铵溶液中少量的Fe2+。
① 酸性溶液中Fe2+与H2O2反应的离子方程式为________________________________。
② 滤渣的化学式为__________。
③ 检验“过滤”后杂质是否除尽的实验方法是____________________________________。
(2) 配制Al2(SO4)3溶液时,需用硫酸酸化的目的是_______________________________。
(3) 铵明矾[NH4Al(SO4)2·12H2O]强热分解的产物为Al2O3、NH3、N2、SO3、SO2和H2O。该反应氧化产物与还原产物的物质的量之比为__________。
(4)强热分解需用酒精喷灯,另外还需用到的硅酸盐质仪器有______(填标号)。
a 烧杯 b 坩埚 c 玻璃棒 d 泥三角
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
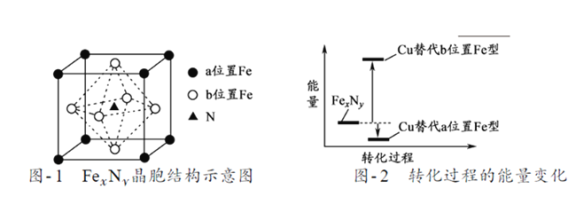
铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为____________________。
(2)丙酮(![]() )分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
)分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
(3)C、H、O 三种元素的电负性由小到大的顺序为________________。
(4)乙醇的沸点高于丙酮,这是因为____________________。
(5)某FexNy的晶胞如题21图-1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n) CunNy。FexNy转化为两种Cu替代型产物的能量变化如题21图-2 所示,其中更稳定的Cu替代型产物的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜常用作有机合成工业中的催化剂,为白色晶体,不溶于乙醇,微溶于水, 易溶于浓盐酸形成络合离子([CuCl2]-)。受潮露置空气中迅速氧化成碱式盐。实验室 用 下列流程制备:
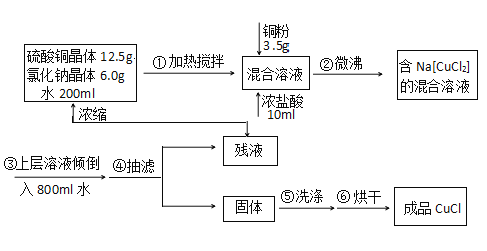
注:Na[CuCl2](易电离,溶液无色)水NaCl+CuCl↓(白色沉淀)。请回答:
(1)写出实验室制取Na[CuCl2]的离子方程式_____________。
(2)判断步骤②反应完全的现象是_______________。
(3)步骤④有关抽滤操作,下列说法正确的是_________。
A. 选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀
B. 在吸滤瓶和抽气泵之间应连接一个安全瓶,吸滤瓶应与安全瓶的长导管相接
C. 抽滤时不宜过滤胶状沉淀,否则易在滤纸上形成一层密实的沉淀
D. 洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物
(4)步骤⑤用乙醇的水溶液洗涤的目的是______________。
(5)步骤⑥烘干须在真空干燥箱中进行,其原因是___________________。
(6)氯化亚铜的定量
①取样品0.25g和10ml过量的FeCl3溶液于250ml锥形瓶中,充分溶解。
②用0.10mol·L-1硫酸锶铈[Ce(SO4)2]标准溶液滴定。
已知:CuCl+FeCl3=CuCl2+FeCl2; Fe2++Ce4+=Fe3++Ce3+
三次平行试验结果如下(平行试验结果相差不能超过1%):
平行试验次数 | 1 | 2 | 3 |
0.25g样品消耗硫酸铈标准溶液的体积(ml) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为____________。(结果保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgCl2、AlCl3的混合溶液中,开始滴加试剂X,之后改滴试剂Y,所得沉淀的物质的量n(mol)与试剂体积V(mL)间的关系如图所示。以下结论错误的是( )
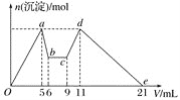
A.X是盐酸,Y是NaOH溶液,且c(Y)=2c(X)
B.原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl-)=1∶1∶5
C.X是NaOH溶液,Y是盐酸,且c(NaOH)∶c(HCl)=2∶1
D.从b至c相应的离子方程式为H++OH-===H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com