
【题目】氯化亚铜常用作有机合成工业中的催化剂,为白色晶体,不溶于乙醇,微溶于水, 易溶于浓盐酸形成络合离子([CuCl2]-)。受潮露置空气中迅速氧化成碱式盐。实验室 用 下列流程制备:
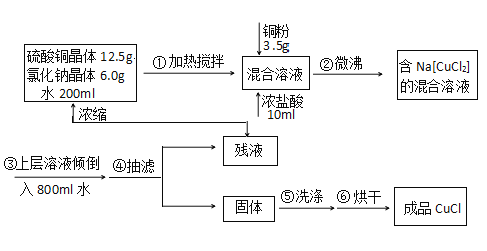
注:Na[CuCl2](易电离,溶液无色)水NaCl+CuCl↓(白色沉淀)。请回答:
(1)写出实验室制取Na[CuCl2]的离子方程式_____________。
(2)判断步骤②反应完全的现象是_______________。
(3)步骤④有关抽滤操作,下列说法正确的是_________。
A. 选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀
B. 在吸滤瓶和抽气泵之间应连接一个安全瓶,吸滤瓶应与安全瓶的长导管相接
C. 抽滤时不宜过滤胶状沉淀,否则易在滤纸上形成一层密实的沉淀
D. 洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物
(4)步骤⑤用乙醇的水溶液洗涤的目的是______________。
(5)步骤⑥烘干须在真空干燥箱中进行,其原因是___________________。
(6)氯化亚铜的定量
①取样品0.25g和10ml过量的FeCl3溶液于250ml锥形瓶中,充分溶解。
②用0.10mol·L-1硫酸锶铈[Ce(SO4)2]标准溶液滴定。
已知:CuCl+FeCl3=CuCl2+FeCl2; Fe2++Ce4+=Fe3++Ce3+
三次平行试验结果如下(平行试验结果相差不能超过1%):
平行试验次数 | 1 | 2 | 3 |
0.25g样品消耗硫酸铈标准溶液的体积(ml) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为____________。(结果保留三位有效数字)
【答案】Cu2++4Cl-+Cu=2[CuCl2]- 反应溶液由蓝色转变为无色透明为止 AD 洗去晶体表面的水和其它杂质 氯化亚铜在潮湿空气中能迅速氧化成碱式盐而变质 95.5%
【解析】
(1)实验室利用硫酸铜、浓盐酸和铜反应制取Na[CuCl2],反应的离子方程式为Cu2++4Cl-+Cu=2[CuCl2]-;
(2)铜离子为蓝色,Na[CuCl2]为无色,如果步骤②反应完全,则溶液中不存在铜离子的颜色,所以判断反应完全的现象是反应溶液由蓝色转变为无色透明为止;
(3)A. 颗粒太小的沉淀易在滤纸上形成一层密实的沉淀,溶液不易透过,则选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀,选项A正确;
B. 在吸滤瓶和抽气泵之间应连接一个安全瓶,吸滤瓶应与安全瓶的短导管相接,否则易使水进入安全瓶,选项B错误;
C. 胶状沉淀易透过滤纸而不宜采用抽滤方法,选项C错误;
D. 在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物,防止沉淀溶解而造成损失,选项D正确。
答案选AD;
(4)由于氯化亚铜不溶于乙醇,微溶于水,所以需用乙醇的水溶液进行洗涤,洗去晶体表面的液体杂质,故步骤⑤用乙醇的水溶液洗涤的目的是:洗去晶体表面的水和其它杂质;
(5)根据题中信息“受潮露置空气中迅速氧化成碱式盐”可知烘干须在真空干燥箱中进行,其原因是氯化亚铜在潮湿空气中能迅速氧化成碱式盐而变质。故步骤⑥烘干须在真空干燥箱中进行,其原因是:氯化亚铜在潮湿空气中能迅速氧化成碱式盐而变质;
(6)根据题目中所给数据及平行实验结果相差不能超过1%,故舍弃第一次数据,利用第二次和第三次数据计算,滴定0.25g样品消耗硫酸铈标准溶液的平均体积是![]() =24.0mL,所以CuCl的纯度为
=24.0mL,所以CuCl的纯度为![]() ×100%=95.5%。
×100%=95.5%。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】根据下列图所示所得出的结论正确的是
A.图甲是一定温度下,处于恒容密闭容器、弱酸性环境下的铁钉发生腐蚀过程中体系压强的变化曲线,可推知初始阶段铁钉主要发生析氢腐蚀
B.图乙是平衡体系2NO2(g)![]() N2O4(g);ΔH=-56.9 kJ·mol-1改变某一条件后v(正)、v(逆)的变化情况,可推知t0时刻改变的条件是升高温度
N2O4(g);ΔH=-56.9 kJ·mol-1改变某一条件后v(正)、v(逆)的变化情况,可推知t0时刻改变的条件是升高温度
C.图丙是某温度下c(CH3COOH)+c(CH3COO-)=0.100 mol·L-1的醋酸与醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH的关系,可推知该温度下pH=3的溶液中:Ka<10-4.75
D.图丁中虚线是2SO2+O2![]() 2SO3在催化剂存在下反应过程中能量的变化情况,可推知催化剂Ⅰ的催化效果更好
2SO3在催化剂存在下反应过程中能量的变化情况,可推知催化剂Ⅰ的催化效果更好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化硼是一种超硬耐磨涂层材料,右图为其晶胞,其中的每个原子均满足8电子稳定结构。
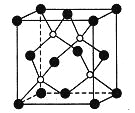
下列有关说法正确的是( )
A. 磷化硼晶体的熔点很低
B. 磷化硼晶体的化学式为BP,属于离子晶体
C. 磷化硼晶体中每个原子均形成4条共价键
D. 磷化硼晶体结构中微粒的空间堆积方式与氯化钠相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是:2NaCl(熔融)![]() 2Na+Cl2↑。回答下列有关单质钠的问题:
2Na+Cl2↑。回答下列有关单质钠的问题:
(1)下列各项中属于保存金属钠的正确方法是____。
A.放在棕色瓶中 B.放在细沙中C.放在水中 D.放在煤油中
(2)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图Ⅰ所示),请写出该反应的化学方程式____________,生成物的颜色为____。将该试管冷却后直立,滴加几滴水(如图Ⅱ所示),发生反应的化学方程式为____________,检验该反应产生的气体的方法是________________。

(3)Na、Na2O、Na2O2、NaOH久置空气中最终都是变为____________(填化学式);过氧化钠与CO2反应的化学方程式__________________________。因此,过氧化钠可作为呼吸面具和潜水艇的氧气来源。
(4)一小块金属钠投入CuCl2溶液中,发生反应的方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室废液中含有Fe3+、Fe2+、Cu2+、Ag+四种金属阳离子,实验室设计了下述方案对废液进行处理,以回收金属,保护环境。
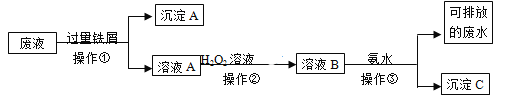
⑴沉淀A的成分是__________________________
⑵操作②中观察到的实验现象是__________________________________________________。
⑶设计一个实验方案,检验可排放的废水中不含Fe3+____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修2化学与技术】
铁在自然界分布广泛,在工业、农业和国防科技中有重要应用。
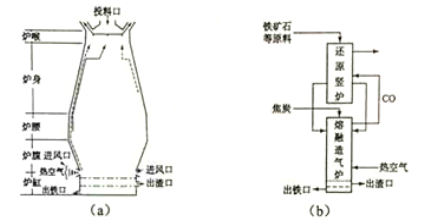
回答下列问题:
(1)用铁矿石(赤铁矿)冶炼生铁的高炉如图(a)所示。原料中除铁矿石和焦炭外含有 。除去铁矿石中脉石(主要成分为SiO2 )的化学反应方程式为 、 ;高炉排出气体的主要成分有N2、CO2 和 (填化学式)。
(2)已知:①Fe2O3 (s)+3C(s)=2Fe(s)+3CO(g) ΔH=+494kJ·mol-1
②CO(g)+O2(g)=CO2(g) ΔH=-283kJ·mol-1
③C(s)+O2(g)=CO(g) ΔH=-110kJ·mol-1
则反应Fe2O3 (s)+3 C(s)+ O2(g)=2Fe(s)+3CO2 (g) 的ΔH= kJ·mol-1。理论上反应 放出的热量足以供给反应 所需的热量(填上述方程式序号)
(3)有人设计出“二步熔融还原法”炼铁工艺,其流程如图(b)所示,其中,还原竖炉相当于高炉的
部分,主要反应的化学方程式为 ;熔融造气炉相当于高炉的 部分。
(4)铁矿石中常含有硫,使高炉气中混有SO2 污染空气,脱SO2 的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法.其反应过程如图所示:

(1)反应I的化学方程式是____________________。
(2)反应I得到的产物用I2进行分离.该产物的溶液在过量I2的存在下会分成两层-含低浓度I2的H2SO4层和含高浓度I2的HI层。
①根据上述事实,下列说法正确的是__________(选填序号)。
a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
②辨别两层溶液的方法是_______________________________。
③经检测,H2SO4层中c(H+):c(SO42-)=2.06:1。其比值大于2的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由两种元素组成的矿物A,测定A的组成及制取化合物D的流程如图:
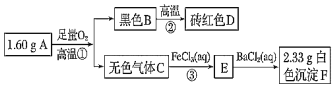
请回答:
(1)A的化学式为______
(2)写出③的离子方程式:______
(3)写出D溶于足量稀硝酸的化学方程式:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气的主要成分有CO、SO2、NO、NO2等。
(1)利用氨水可以将SO2、NO2吸收,原理如下图所示。
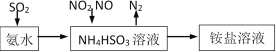
请写出NO2被吸收反应的离子方程式___________________。
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:反应Ⅰ:2NO(g)+O2(g)==2NO2(g) ΔH1 =—113.0 kJ·molˉ1
反应Ⅱ:2SO2(g)+O2(g)==2SO3(1) ΔH2 =—288.4 kJ·molˉ1
反应Ⅲ:3NO2(g)+H2O(g)==2HNO3+NO(g) ΔH3 =—138.0 kJ·molˉ1
则反应NO2(g)+SO2(g)==NO(g)+SO3(1) ΔH4= _______________。
②已知TiO2催化尾气降解原理可表示为:2CO(g)+O2(g) ![]() 2CO2(g) ΔH5; 2H2O(g)+4NO(g)+3O2(g)
2CO2(g) ΔH5; 2H2O(g)+4NO(g)+3O2(g) ![]() 4HNO3(g) ΔH6。
4HNO3(g) ΔH6。
在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如图所示。请解释ts后NO降解率下降的可能原因_____________________。
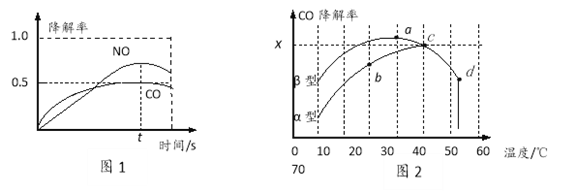
(3)沥青混凝土也可降解CO。如图为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合如图回答下列问题:
①已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L—1,求此温度下CO降解反应的平衡常数_______________。
②下列关于如图的叙述正确的是_________________
A.降解率由b点到c点随温度的升高而增大,可知CO降解反应的平衡常数Kb<Kc
B.相同温度下β型沥青混凝土中CO降解速率比α型要大
C.d点降解率出现突变的原因可能是温度升高后催化剂失效
③科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10℃~60℃范围内进行实验,请在如图中用线段与“![]() ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围_____________。
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围_____________。
(4)TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,写出阳极的电极反应式 ____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com