
����Ŀ��������һ�ּ��߷�չDZ���������Դ����̫����Ϊ��Դ���Ȼ�ѧ���ѭ���ֽ�ˮ��һ�ָ�Ч������Ⱦ�����ⷽ�����䷴Ӧ������ͼ��ʾ��

��1����ӦI�Ļ�ѧ����ʽ��____________________��
��2����ӦI�õ��IJ�����I2���з��룮�ò������Һ�ڹ���I2�Ĵ����»�ֳ����㣭����Ũ��I2��H2SO4��ͺ���Ũ��I2��HI�㡣
�ٸ���������ʵ������˵����ȷ����__________��ѡ����ţ���
a��������Һ���ܶȴ��ڲ���
b����I2ǰ��H2SO4��Һ��HI��Һ������
c��I2��HI��Һ�б���H2SO4��Һ������
�ڱ��������Һ�ķ�����_______________________________��
�۾���⣬H2SO4����c��H+����c��SO42����=2.06��1�����ֵ����2��ԭ����____________��
���𰸡�SO2+2H2O+I2=H2SO4+2HI ac �۲���ɫ����ɫ���ΪHI�㣬��ɫdz��Ϊ����� ������к�������HI����HI����������ӣ�
��������
��1����ͼ��֪����ӦIΪ����������ⷢ��������ԭ��Ӧ���������HI���÷�ӦΪSO2+2H2O+I2=H2SO4+2HI��
��2����a��������Һ���ܶȴ��ڲ�ų������²㣬��a��ȷ��
b����I2ǰ��H2SO4��Һ��HI��Һ���ܣ���ֲ��أ���b����
c��I2��HI��Һ�б���H2SO4��Һ�����ܣ�����ڲ�ͬ�ܼ����ܽ��Բ�ͬ��������ȡ����ֲ��йأ���c��ȷ����ѡac��
�ڱ��������Һ�ķ����ǹ۲���ɫ����ɫ���ΪHI�㣬��ɫdz��Ϊ����㣻
��H2SO4����c��H+����c��SO42����=2.06��1�����ֵ����2��ԭ����������к�������HI����HI����������ӡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʮ�����[(NH4)xH6��xV10O28��yH2O(���з�Ϊ��5��)]����������߶˷����Ͻ�
��. (NH4)xH6��xV10O28��yH2O���Ʊ�
��NH4VO3����pHΪ4�������Խ��ʺ����Ҵ������˵õ�(NH4)xH6��xV10O28��yH2O���塣�Ҵ���������____________________________________��
��. (NH4)xH6��xV10O28��yH2O����ɲⶨ
(1) NH4+�����ⶨ
ȷ��ȡ0.363 6 g��ʮ����茶��壬��������ˮ��NaOH��Һ��������У����ɵİ�����20.00 mL 0.100 0 mol��L��1�������Һ���ա��õ�Ũ�ȵ�NaOH����Һ�ζ��������ᣬ����NaOH����Һ8.00 mL��
(2) V10O![]() (M��958 g��mol��1)�����ⶨ
(M��958 g��mol��1)�����ⶨ
����1��ȷ��ȡ0.3636 g��ʮ����茶��壬��������ϡ���ᣬ��ʹ֮�ܽ⡣
����2����������ˮ��NaHSO3����ֽ��裬ʹV10O![]() ��ȫת��ΪVO2����
��ȫת��ΪVO2����
����3��������ϡ�����ữ��������У���ȥ��Һ�У�4����
����4����0.020 00 mol��L��1 KMnO4����Һ�ζ����յ�ʱ����30.00 mL KMnO4����Һ(�ù����з�����������5�ۣ��̱���ԭ����2��)��
��д������2��Ӧ�����ӷ���ʽ��____________________________________��
����δ���в���3����������ֵy��________(����ƫ������ƫС��������Ӱ����)��
��ͨ������ȷ����ʮ����茶���Ļ�ѧʽ(д���������)��________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
����������(FexNy)�ڴż�¼�����������Ź㷺��Ӧ��ǰ����ijFexNy���Ʊ���������������ͪ���Ҵ����롣
��1��Fe3+��̬��������Ų�ʽΪ____________________��
��2����ͪ(![]() )������̼ԭ�ӹ�����ӻ�������_______________,1 mol ��ͪ�����к��ЦҼ�����ĿΪ______________��
)������̼ԭ�ӹ�����ӻ�������_______________,1 mol ��ͪ�����к��ЦҼ�����ĿΪ______________��
��3��C��H��O ����Ԫ�صĵ縺����С�����˳��Ϊ________________��
��4���Ҵ��ķе���ڱ�ͪ,������Ϊ____________________��
��5��ijFexNy�ľ�������21ͼ-1��ʾ,Cu������ȫ����þ�����aλ��Fe����bλ��Fe,�γ�Cu����Ͳ���Fe(x-n) CunNy��FexNyת��Ϊ����Cu����Ͳ���������仯����21ͼ-2 ��ʾ,���и��ȶ���Cu����Ͳ���Ļ�ѧʽΪ___________��
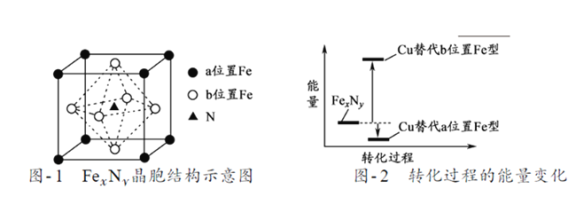
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���ͭ�������л��ϳɹ�ҵ�еĴ�����Ϊ��ɫ���壬�������Ҵ�������ˮ�� ������Ũ�����γ�������ӣ�[CuCl2]�������ܳ�¶�ÿ�����Ѹ�������ɼ�ʽ�Ρ�ʵ���� �� ���������Ʊ���
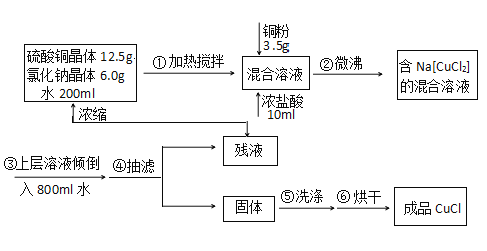
ע��Na[CuCl2](���룬��Һ��ɫ)ˮNaCl+CuCl��(��ɫ����)����ش�
��1��д��ʵ������ȡNa[CuCl2]�����ӷ���ʽ_____________��
��2���жϲ���ڷ�Ӧ��ȫ��������_______________��
��3��������йس��˲���������˵����ȷ����_________��
A. ѡ�������Ҫ��Ϊ�˼ӿ�����ٶȣ��õ��ϸ���ij���
B. ������ƿ�ͳ�����֮��Ӧ����һ����ȫƿ������ƿӦ�밲ȫƿ�ij��������
C. ����ʱ���˹��˽�״����������������ֽ���γ�һ����ʵ�ij���
D. ϴ�ӳ���ʱ��Ӧ��Сˮ��ͷ��ʹϴ�Ӽ�����ͨ��������
��4����������Ҵ���ˮ��Һϴ�ӵ�Ŀ����______________��
��5��������������ո������н��У���ԭ����___________________��
��6���Ȼ���ͭ�Ķ���
��ȡ��Ʒ0.25g��10ml������FeCl3��Һ��250ml��ƿ�У�����ܽ⡣
����0.10mol��L��1��������[Ce(SO4)2]����Һ�ζ���
��֪��CuCl+FeCl3=CuCl2+FeCl2�� Fe2++Ce4+=Fe3++Ce3+
����ƽ�����������£�ƽ�����������ܳ���1%����
ƽ��������� | 1 | 2 | 3 |
0.25g��Ʒ�������������Һ�������ml�� | 24.35 | 24.05 | 23.95 |
����Ʒ��CuCl�Ĵ���Ϊ____________�������������λ��Ч���֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������Ԫ��X��Y��Z��Q�����ڱ��е�λ����ͼ��ʾ��X��Y��W������������֮����Qԭ�Ӻ�����������ȡ�����˵���в���ȷ���ǣ�������
X | Y | ||
Z | Q | ||
W |
A. ���Ӱ뾶![]() ��r(Wm-)>r(Qm-)>r(Zn-)
��r(Wm-)>r(Qm-)>r(Zn-)
B. Ԫ��Z��Y�Ļ��ϼ۶����ܴ���![]() ��
��
C. �����Ʋ�HWO4��W������������ˮ����
D. XԪ�ص��⻯������࣬��������WԪ�صĵ��ʷ�����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷��Ǻ���һ�����ᾧˮ�������������ڹ�ũҵ�����о�����Ҫ����;��ij��ѧ��ȤС����̷���һЩ���ʽ���̽�����ش��������⣺
��1�����Թ��м��������̷���Ʒ����ˮ�ܽ⣬�μ�KSCN��Һ����Һ��ɫ�����Ա仯�������Թ���ͨ���������Һ��졣�ɴ˿�֪��______________��_______________��
��2��Ϊ�ⶨ�̷��нᾧˮ��������ʯӢ�����ܣ����˿���K1��K2������Ϊװ��A�����أ���Ϊm1 g������Ʒװ��ʯӢ�������У��ٴν�װ��A���أ���Ϊ m2 g������ͼ���Ӻ�װ�ý���ʵ�顣

������B��������____________________��
�ڽ�����ʵ�����������ȷ����___________________�����ţ����ظ������������裬ֱ��A���أ���Ϊm3 g��
a.��ȼ�ƾ��ƣ����� b.Ϩ��ƾ��� c.�ر�K1��K2
d.��K1��K2������ͨ��N2 e.����A f.��ȴ������
�۸���ʵ���¼�������̷���ѧʽ�нᾧˮ��Ŀx=________________����ʽ��ʾ������ʵ��ʱ��a��d�����������ʹx__________���ƫ��ƫС������Ӱ�족����
��3��Ϊ̽�����������ķֽ�������2�����Ѻ��ص�װ��A������ͼ��ʾ��װ���У���K1��K2������ͨ��N2�����ȡ�ʵ���Ӧ���в�������Ϊ��ɫ��ĩ��

��C��D�е���Һ����Ϊ_________�����ţ���C��D��������ð�������ɹ۲쵽������ֱ�Ϊ_______________��
a��Ʒ�� b��NaOH c��BaCl2 d��Ba(NO3)2 e��ŨH2SO4
��д�������������·ֽⷴӦ�Ļ�ѧ����ʽ_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.100molL-1NaOH��Һ�ζ�25.00 mL 0.100molL-1H2C2O4��Һ�����õζ�������ͼ��ʾ�������Һ������ɿ��ɻ��ǰ��Һ�����֮�ͣ�������˵������ȷ���ǣ�������

A. X ����ʾ��Һ�У�c(Na+)>c(HC2O4-)>c(C2O42-)
B. �۲�Y����ʾ��Һ��˵��HC2O4-�ĵ���̶ȴ���C2O42-��ˮ��̶�
C. Z ����ʾ��Һ�У�c(Na+)>c(C2O42-))>c(HC2O4-)>c(OH-)>c(H+)
D. �����ζ������У�c(Na+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100molL-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����MgCl2��AlCl3�Ļ����Һ�У���ʼ�μ��Լ�X��֮��ĵ��Լ�Y�����ó��������ʵ���n(mol)���Լ����V(mL)��Ĺ�ϵ��ͼ��ʾ�����½��۴������(����)
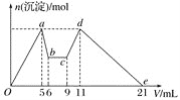
A.X�����ᣬY��NaOH��Һ����c(Y)��2c(X)
B.ԭ���Һ�У�c(Al3��)��c(Mg2��)��c(Cl��)��1��1��5
C.X��NaOH��Һ��Y�����ᣬ��c(NaOH)��c(HCl)��2��1
D.��b��c��Ӧ�����ӷ���ʽΪH����OH��===H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cr��S��Ԫ�صĻ����ﳣ�����һЩ�������⣬���й����������о��ø��ֻ�ѧ������������Щ���ʶԻ�����Ӱ�졣
��1����ԭ�������Ǵ���������Cr2O72��CrO42����ҵ��ˮ�ij��÷������������£�
![]()
����֪�������£���ʼŨ��Ϊ1.0 mol��L1��Na2CrO4��Һ��c(Cr2O72)��c(H+)�ı仯��ͼ��ʾ��������������CrO42-ת��ΪCr2O72-�����ӷ���ʽΪ______________________��

����ԭ�������������뻹ԭ�������ʵ���֮��Ϊ__________��
��Cr3+��Al3+�Ļ�ѧ�������ƣ���CrCl3��Һ���ɲ����գ����յõ��Ĺ���Ļ�ѧʽΪ____________��
�������£�Ksp[Cr(OH)3]=1.0��10-32����ʹ�������ˮ�е�c(Cr3+)����1.0��10-5mol��L1����������ȫ����Ӧ��������Һ��pH=_____��
��2�����������η����������е�SO2
��������ͨ��1.0mol/L ��Na2SO3��Һ����Na2SO3ǡ����ȫ��Ӧʱ����ҺpHԼΪ3����ʱ����Һ�и�������Ũ���ɴ�С��˳��Ϊ_________��������Ũ�ȷ��ź��������ű�ʾ����
�������£����̵���ͨ��(NH4)2SO3��Һ�У������ҺpH�뺬��������ʵ��������ı仯��ϵ��ͼ��ʾ��

��֪����������ʵĵ��볣����25�棩���£�
����� | ���볣�� |
H2SO3 | Ka1=1.54��10-2 Ka2=1.02��10-7 |
NH3��H2O | Kb=1.74��10-5 |
��i��(NH4)2SO3��Һ��____�����������������������������ԣ���ԭ����_________________��
��ii��ͼ��b��ʱ��ҺpH=7����n(NH4+):n(HSO3- )=_________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com