
ЁОЬтФПЁПИпДПЖШбѕЛЏТС(Al2O3)ЕФгУЭОКмЙуЁЃЪЕбщЪвгУ(NH4)2SO4ЁЂH2O2ЁЂАБЫЎЁЂAl2(SO4)3ЮЊдСЯЃЌЭЈЙ§вдЯТЙ§ГЬжЦБИAl2O3ЃК
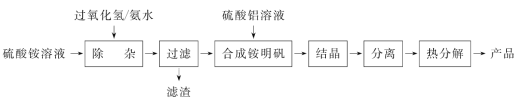
ЃЈ1ЃЉЁАГ§дгЁБВйзїЪЧМгШыH2O2КѓЃЌгУАБЫЎЕїНкШмвКЕФpHдМЮЊ3ЃЌвдГ§ШЅСђЫсяЇШмвКжаЩйСПЕФFe2ЃЋЁЃ
Ђй ЫсадШмвКжаFe2ЃЋгыH2O2ЗДгІЕФРызгЗНГЬЪНЮЊ________________________________ЁЃ
Ђк ТЫдќЕФЛЏбЇЪНЮЊ__________ЁЃ
Ђл МьбщЁАЙ§ТЫЁБКѓдгжЪЪЧЗёГ§ОЁЕФЪЕбщЗНЗЈЪЧ____________________________________ЁЃ
ЃЈ2ЃЉ ХфжЦAl2(SO4)3ШмвКЪБЃЌашгУСђЫсЫсЛЏЕФФПЕФЪЧ_______________________________ЁЃ
ЃЈ3ЃЉ яЇУїЗЏ[NH4Al(SO4)2ЁЄ12H2O]ЧПШШЗжНтЕФВњЮяЮЊAl2O3ЁЂNH3ЁЂN2ЁЂSO3ЁЂSO2КЭH2OЁЃИУЗДгІбѕЛЏВњЮягыЛЙдВњЮяЕФЮяжЪЕФСПжЎБШЮЊ__________ЁЃ
ЃЈ4ЃЉЧПШШЗжНташгУОЦОЋХчЕЦЃЌСэЭтЛЙашгУЕНЕФЙшЫсбЮжЪвЧЦїга______(ЬюБъКХ)ЁЃ
a ЩеБ b лслі c ВЃСЇАє d ФрШ§НЧ
ЁОД№АИЁП2Fe2ЃЋЃЋH2O2ЃЋ2HЃЋ==2Fe3ЃЋЃЋ2H2O Fe(OH)3 ШЁЩйСПЙ§ТЫКѓШмвКгкЪдЙмжаЃЌЕЮШыМИЕЮKSCNШмвКЃЌШєШмвКЮДБфКьЩЋЃЌЫЕУїдгжЪвбОГ§ОЁ вжжЦAl3ЃЋЫЎНт 1ЁУ3 bcd
ЁОНтЮіЁП
ЃЈ1ЃЉЂйбЧЬњРызгОпгаЛЙдадЃЌЫЋбѕЫЎОпгаЧПбѕЛЏадЃЌдкЫсадШмвКжаЃЌбЧЬњРызгБЛбѕЛЏЩњГЩЬњРызгЃЛ
ЂкH2O2ШмвКОпгаЧПбѕЛЏадЃЌПЩвдбѕЛЏбЧЬњРызгЩњГЩЬњРызгЃЌЬњРызгдкАБЫЎДцдкЕФЬѕМўЯТЩњГЩЧтбѕЛЏЬњКьКжЩЋГСЕэЃЛ
ЂлгЩЙЄвеСїГЬПЩжЊЃЌМгШыЙ§бѕЛЏЧтНЋШмвКжаFe2+бѕЛЏЮЊFe3+ЃЌМгШыАБЫЎЕїНкШмвКpHжЕЃЌFe3+ЪЙзЊЛЏЮЊFe(OH)3ЃЌЙ§ТЫКѓЕФТЫвКжаПЩФмКЌгаFe3+ЃЌШЁЩйаэТЫвКгкЪдЙмжаЃЌМгМИЕЮKSCNШмвКЃЌШєШмвКВЛБфКьЩЋЃЌдђдгжЪвбГ§ОЁЃЛ
ЃЈ2ЃЉгЩгкТСРызгдкШмвКжаФмЙЛЗЂЩњЫЎНтЩњГЩЧтбѕЛЏТСЃЌЫљвдМгШыСђЫсЫсЛЏЃЌвжжЦСЫТСРызгЕФЫЎНтЃЛ
ЃЈ3ЃЉ(NH4)2SO4дкИпЮТЯТЗжНтЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃК3(NH4)2SO4![]() 3SO2ЁќЃЋN2ЁќЃЋ4NH3ЁќЃЋ6H2OЃЛN2ЪЧбѕЛЏВњЮяЃЌSO42ЁњSO2жаСђдЊЫиЕФЛЏКЯМлгЩ+6МлЁњ+4МлЃЌЫљвдSO2ЪЧЛЙдВњЮяЃЌгЩЗДгІЗНГЬЪНЕФМЦСПЯЕЪ§ПЩжЊЃЌбѕЛЏВњЮяКЭЛЙдВњЮяЕФЮяжЪЕФСПжЎБШЮЊ1:3ЃЛ
3SO2ЁќЃЋN2ЁќЃЋ4NH3ЁќЃЋ6H2OЃЛN2ЪЧбѕЛЏВњЮяЃЌSO42ЁњSO2жаСђдЊЫиЕФЛЏКЯМлгЩ+6МлЁњ+4МлЃЌЫљвдSO2ЪЧЛЙдВњЮяЃЌгЩЗДгІЗНГЬЪНЕФМЦСПЯЕЪ§ПЩжЊЃЌбѕЛЏВњЮяКЭЛЙдВњЮяЕФЮяжЪЕФСПжЎБШЮЊ1:3ЃЛ
ЃЈ4ЃЉзЦЩегІдклсліжаНјааЃЌДЩлсліЁЂФрШ§НЧЁЂВЃСЇАєХфЬзЪЙгУЃЌЦфжаДЩлсліЪЧЬеДЩзіЕФЃЌФрШ§НЧЙшЫсбЮзіЕФЃЌВЃСЇЕФжївЊГЩЗжЪЧЙшЫсФЦЃЌЪєгкЙшЫсбЮжЪЕФвЧЦїгаbcdЁЃ
ЃЈ1ЃЉЂйбЧЬњРызгОпгаЛЙдадЃЌЫЋбѕЫЎОпгаЧПбѕЛЏадЃЌдкЫсадШмвКжаЃЌбЧЬњРызгБЛбѕЛЏЩњГЩЬњРызгЃЌДЫЗДгІЕФРызгЗДгІЗНГЬЪНЮЊЃК2Fe2++H2O2+2H+=2Fe3++2H2OЁЃБОаЁЬтД№АИЮЊЃК2Fe2++H2O2+2H+=2Fe3++2H2OЁЃ
ЂкH2O2ШмвКОпгаЧПбѕЛЏадЃЌПЩвдбѕЛЏбЧЬњРызгЩњГЩЬњРызгЃЌЬњРызгдкАБЫЎДцдкЕФЬѕМўЯТЩњГЩЧтбѕЛЏЬњКьКжЩЋГСЕэЃЌЗДгІЕФРызгЗНГЬЪНЃК2Fe2++H2O2+4NH3H2O=2Fe(OH)3Ё§+4NH4+ЃЌЙ§ТЫВйзїжаЫљЕУЕНТЫдќжївЊГЩЗжЧтбѕЛЏЬњЃЌЛЏбЇЪНЮЊFe(OH)3ЁЃБОаЁЬтД№АИЮЊЃКFe(OH)3ЁЃ
ЂлгЩЙЄвеСїГЬПЩжЊЃЌМгШыЙ§бѕЛЏЧтНЋШмвКжаFe2+бѕЛЏЮЊFe3+ЃЌМгШыАБЫЎЕїНкШмвКpHжЕЃЌFe3+ЪЙзЊЛЏЮЊFe(OH)3ЃЌЙ§ТЫКѓЕФТЫвКжаПЩФмКЌгаFe3+ЃЌШЁЩйаэТЫвКгкЪдЙмжаЃЌМгМИЕЮKSCNШмвКЃЌШєШмвКВЛБфКьЩЋЃЌдђдгжЪвбГ§ОЁЁЃБОаЁЬтД№АИЮЊЃКШЁЩйСПЙ§ТЫКѓШмвКгкЪдЙмжаЃЌЕЮШыМИЕЮKSCNШмвКЃЌШєШмвКЮДБфКьЩЋЃЌЫЕУїдгжЪвбОГ§ОЁЁЃ
ЃЈ2ЃЉгЩгкТСРызгдкШмвКжаФмЙЛЗЂЩњЫЎНтЩњГЩЧтбѕЛЏТСЃЌЫљвдМгШыСђЫсЫсЛЏЃЌвжжЦСЫТСРызгЕФЫЎНтЁЃБОаЁЬтД№АИЮЊЃКвжжЦAl3ЃЋЫЎНтЁЃ
ЃЈ3ЃЉ(NH4)2SO4дкИпЮТЯТЗжНтЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃК3(NH4)2SO4![]() 3SO2ЁќЃЋN2ЁќЃЋ4NH3ЁќЃЋ6H2OЃЛN2ЪЧбѕЛЏВњЮяЃЌSO42ЁњSO2жаСђдЊЫиЕФЛЏКЯМлгЩ+6МлЁњ+4МлЃЌЫљвдSO2ЪЧЛЙдВњЮяЃЌгЩЗДгІЗНГЬЪНЕФМЦСПЯЕЪ§ПЩжЊЃЌбѕЛЏВњЮяКЭЛЙдВњЮяЕФЮяжЪЕФСПжЎБШЮЊ1:3ЁЃБОаЁЬтД№АИЮЊЃК1:3ЁЃ
3SO2ЁќЃЋN2ЁќЃЋ4NH3ЁќЃЋ6H2OЃЛN2ЪЧбѕЛЏВњЮяЃЌSO42ЁњSO2жаСђдЊЫиЕФЛЏКЯМлгЩ+6МлЁњ+4МлЃЌЫљвдSO2ЪЧЛЙдВњЮяЃЌгЩЗДгІЗНГЬЪНЕФМЦСПЯЕЪ§ПЩжЊЃЌбѕЛЏВњЮяКЭЛЙдВњЮяЕФЮяжЪЕФСПжЎБШЮЊ1:3ЁЃБОаЁЬтД№АИЮЊЃК1:3ЁЃ
ЃЈ4ЃЉзЦЩегІдклсліжаНјааЃЌДЩлсліЁЂФрШ§НЧЁЂВЃСЇАєХфЬзЪЙгУЃЌЦфжаДЩлсліЪЧЬеДЩзіЕФЃЌФрШ§НЧЙшЫсбЮзіЕФЃЌВЃСЇЕФжївЊГЩЗжЪЧЙшЫсФЦЃЌЪєгкЙшЫсбЮжЪЕФвЧЦїгаbcdЁЃБОаЁЬтД№АИЮЊЃКbcdЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙигкФЦМАЦфЛЏКЯЮяаджЪЕФа№ЪіЃЌе§ШЗЕФЪЧЃЈ ЃЉ
A.ФЦЕФЛЏбЇаджЪЛюЦУ,ПЩвдКЭ![]() ШмвКЗДгІжЦШЁН№Ъєюб
ШмвКЗДгІжЦШЁН№Ъєюб
B.бѕЛЏФЦКЭЙ§бѕЛЏФЦЖМФмгыЖўбѕЛЏЬМЗДгІ,ЩњГЩЮяЭъШЋЯрЭЌ
C.Й§бѕЛЏФЦЪЧЕЛЦЩЋЙЬЬх,ПЩгУгкКєЮќУцОпжазїЮЊбѕЦјЕФРДдД
D.![]() гыЫсЗДгІЕФОчСвГЬЖШЧПгк
гыЫсЗДгІЕФОчСвГЬЖШЧПгк![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПАбЭМ2ЕФЫщжНЦЌВЙГфЕНЭМ1жаЃЌПЩЕУЕНвЛИіЭъећЕФбѕЛЏЛЙдЗДгІЕФРызгЗНГЬЪНЃЈЮДХфЦНЃЉЁЃЯТСаЖдИУЗДгІЕФЫЕЗЈВЛе§ШЗЕФЪЧ

A. IO4ЉзїбѕЛЏМС
B. Шєга1 mol Mn2+ВЮМгЗДгІзЊвЦ5molЕчзг
C. ЛЙдМСгыбѕЛЏМСЕФЮяжЪЕФСПжЎБШЮЊ2ЃК5
D. ХфЦНКѓH+ЁЂMn2+ЕФЛЏбЇМЦСПЪ§ЗжБ№ЮЊ4ЁЂ2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋвЛЖЈжЪСПЕФMgКЭAlЛьКЯЮяЭЖШыЕН200mLЯЁСђЫсжаЃЌЙЬЬхШЋВПШмНтКѓЃЌЯђЫљЕУШмвКжаЕЮМгNaOHШмвКжСЙ§СПЃЌЩњГЩГСЕэЕФЮяжЪЕФСПгыМгШыNaOHШмвКЕФЬхЛ§ЙиЯЕШчЭМЫљЪОЁЃдђЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ

A. MgКЭAlЕФзмжЪСПЮЊ9g
B. зюГѕ20mLNaOHШмвКгУгкжаКЭЙ§СПЕФЯЁСђЫс
C. NaOHШмвКЮяжЪЕФСПХЈЖШЮЊ5molЁЄL-1
D. ЩњГЩЕФЧтЦјдкБъзМзДПіЯТЕФЬхЛ§ЮЊ11.2L
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПСзЛЏХ№ЪЧвЛжжГЌгВФЭФЅЭПВуВФСЯЃЌгвЭМЮЊЦфОЇАћЃЌЦфжаЕФУПИідзгОљТњзу8ЕчзгЮШЖЈНсЙЙЁЃ
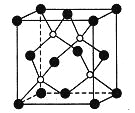
ЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A. СзЛЏХ№ОЇЬхЕФШлЕуКмЕЭ
B. СзЛЏХ№ОЇЬхЕФЛЏбЇЪНЮЊBPЃЌЪєгкРызгОЇЬх
C. СзЛЏХ№ОЇЬхжаУПИідзгОљаЮГЩ4ЬѕЙВМлМќ
D. СзЛЏХ№ОЇЬхНсЙЙжаЮЂСЃЕФПеМфЖбЛ§ЗНЪНгыТШЛЏФЦЯрЭЌ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГаЁзщдкбщжЄЗДгІЁАFe+2Ag+=Fe2++2AgЁБЕФЪЕбщжаМьВтЕНFe3+ЃЌЗЂЯжКЭЬНОПЙ§ГЬШчЯТЁЃ
ЯђЯѕЫсЫсЛЏЕФ0.05 molЁЄL-1ЯѕЫсвјШмвКЃЈpHЁж2ЃЉжаМгШыЙ§СПЬњЗлЃЌНСАшКѓОВжУЃЌЩеБЕзВПгаКкЩЋЙЬЬхЃЌШмвКГЪЛЦЩЋЁЃ
ЃЈ1ЃЉМьбщВњЮя
ЂйШЁЩйСПКкЩЋЙЬЬхЃЌЯДЕгКѓЃЌ_______ЃЈЬюВйзїКЭЯжЯѓЃЉЃЌжЄУїКкЩЋЙЬЬхжаКЌгаAgЁЃ
ЂкШЁЩЯВуЧхвКЃЌЕЮМгK3[Fe(CN)6]ШмвКЃЌВњЩњРЖЩЋГСЕэЃЌЫЕУїШмвКжаКЌга_______________ЁЃ
ЃЈ2ЃЉеыЖдЁАШмвКГЪЛЦЩЋЁБЃЌМзШЯЮЊШмвКжагаFe3+ЃЌввШЯЮЊЬњЗлЙ§СПЪБВЛПЩФмгаFe3+ЃЌвввРОнЕФдРэЪЧ___________________ЃЈгУРызгЗНГЬЪНБэЪОЃЉЁЃеыЖдСНжжЙлЕуМЬајЪЕбщЃК
ЂйШЁЩЯВуЧхвКЃЌЕЮМгKSCNШмвКЃЌШмвКБфКьЃЌжЄЪЕСЫМзЕФВТВтЁЃЭЌЪБЗЂЯжгаАзЩЋГСЕэВњЩњЃЌЧвШмвКбеЩЋБфЧГЁЂГСЕэСПЖрЩйгыШЁбљЪБМфгаЙиЃЌЖдБШЪЕбщМЧТМШчЯТЃК
ађКХ | ШЁбљЪБМф/min | ЯжЯѓ |
ЂЁ | 3 | ВњЩњДѓСПАзЩЋГСЕэЃЛШмвКГЪКьЩЋ |
ЂЂ | 30 | ВњЩњАзЩЋГСЕэЃЛНЯ3 minЪБСПЩйЃЛШмвККьЩЋНЯ3 minЪБМгЩю |
ЂЃ | 120 | ВњЩњАзЩЋГСЕэЃЛНЯ30 minЪБСПЩйЃЛШмвККьЩЋНЯ30 minЪББфЧГ |
ЃЈзЪСЯЃКAg+гыSCN-ЩњГЩАзЩЋГСЕэAgSCNЃЉ
Ђк ЖдFe3+ВњЩњЕФдвђзїГіШчЯТМйЩшЃК
МйЩшaЃКПЩФмЪЧЬњЗлБэУцгабѕЛЏВуЃЌФмВњЩњFe3+ЃЛ
МйЩшbЃКПеЦјжаДцдкO2ЃЌгЩгк________ЃЈгУРызгЗНГЬЪНБэЪОЃЉЃЌПЩВњЩњFe3+ЃЛ
МйЩшcЃКЫсадШмвКжаNO3-ОпгабѕЛЏадЃЌПЩВњЩњFe3+ЃЛ
МйЩшdЃКИљОн_______ЯжЯѓЃЌХаЖЯШмвКжаДцдкAg+ЃЌПЩВњЩњFe3+ЁЃ
Ђл ЯТСаЪЕбщЂёПЩжЄЪЕМйЩшaЁЂbЁЂcВЛЪЧВњЩњFe3+ЕФжївЊдвђЁЃЪЕбщЂђПЩжЄЪЕМйЩшdГЩСЂЁЃ
ЪЕбщЂёЃКЯђЯѕЫсЫсЛЏЕФ________ШмвКЃЈpHЁж2ЃЉжаМгШыЙ§СПЬњЗлЃЌНСАшКѓОВжУЃЌВЛЭЌЪБМфШЁЩЯВуЧхвКЕЮМгKSCNШмвКЃЌ3 minЪБШмвКГЪЧГКьЩЋЃЌ30 minКѓШмвКМИКѕЮоЩЋЁЃ
ЪЕбщЂђЃКзАжУШчЭМЁЃЦфжаМзШмвКЪЧ________ЃЌВйзїМАЯжЯѓЪЧ________________ЁЃ
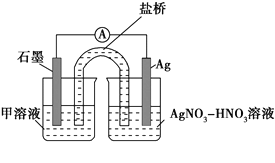
ЃЈ3ЃЉИљОнЪЕбщЯжЯѓЃЌНсКЯЗНГЬЪНЭЦВтЪЕбщЂЁ~ЂЃжаFe3+ХЈЖШБфЛЏЕФдвђЃК______ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПН№ЪєФЦЪЧдк1807ФъЭЈЙ§ЕчНтЧтбѕЛЏФЦжЦЕУЕФЃЌетИідРэгІгУгкЙЄвЕЩњВњЃЌдМдк1891ФъВХЛёЕУГЩЙІЁЃ1921ФъЪЕЯжСЫЕчНтТШЛЏФЦжЦФЦЕФЙЄвЕЗНЗЈЃЌЦфЗДгІдРэЪЧЃК2NaCl(ШлШк)![]() 2Na+Cl2ЁќЁЃЛиД№ЯТСагаЙиЕЅжЪФЦЕФЮЪЬтЃК
2Na+Cl2ЁќЁЃЛиД№ЯТСагаЙиЕЅжЪФЦЕФЮЪЬтЃК
ЃЈ1ЃЉЯТСаИїЯюжаЪєгкБЃДцН№ЪєФЦЕФе§ШЗЗНЗЈЪЧ____ЁЃ
AЃЎЗХдкзиЩЋЦПжа BЃЎЗХдкЯИЩГжаCЃЎЗХдкЫЎжа DЃЎЗХдкУКгЭжа
ЃЈ2ЃЉНЋвЛаЁПщФЦЗХдкЫЎЦНЗХжУЕФЪдЙмжаВПЃЌгУОЦОЋЕЦМгШШГфЗжЗДгІ(ШчЭМЂёЫљЪО)ЃЌЧыаДГіИУЗДгІЕФЛЏбЇЗНГЬЪН____________ЃЌЩњГЩЮяЕФбеЩЋЮЊ____ЁЃНЋИУЪдЙмРфШДКѓжБСЂЃЌЕЮМгМИЕЮЫЎ(ШчЭМЂђЫљЪО)ЃЌЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ____________ЃЌМьбщИУЗДгІВњЩњЕФЦјЬхЕФЗНЗЈЪЧ________________ЁЃ

ЃЈ3ЃЉNaЁЂNa2OЁЂNa2O2ЁЂNaOHОУжУПеЦјжазюжеЖМЪЧБфЮЊ____________ЃЈЬюЛЏбЇЪНЃЉЃЛЙ§бѕЛЏФЦгыCO2ЗДгІЕФЛЏбЇЗНГЬЪН__________________________ЁЃвђДЫЃЌЙ§бѕЛЏФЦПЩзїЮЊКєЮќУцОпКЭЧБЫЎЭЇЕФбѕЦјРДдДЁЃ
ЃЈ4ЃЉвЛаЁПщН№ЪєФЦЭЖШыCuCl2ШмвКжаЃЌЗЂЩњЗДгІЕФЗНГЬЪНЮЊ___________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЁОЛЏбЇЁЊЁЊбЁао2ЛЏбЇгыММЪѕЁП
ЬњдкздШЛНчЗжВМЙуЗКЃЌдкЙЄвЕЁЂХЉвЕКЭЙњЗРПЦММжагаживЊгІгУЁЃ
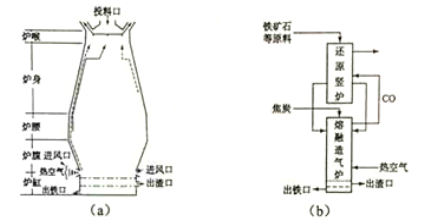
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉгУЬњПѓЪЏЃЈГрЬњПѓЃЉвБСЖЩњЬњЕФИпТЏШчЭМЃЈaЃЉЫљЪОЁЃдСЯжаГ§ЬњПѓЪЏКЭНЙЬПЭтКЌга ЁЃГ§ШЅЬњПѓЪЏжаТіЪЏЃЈжївЊГЩЗжЮЊSiO2 ЃЉЕФЛЏбЇЗДгІЗНГЬЪНЮЊ ЁЂ ЃЛИпТЏХХГіЦјЬхЕФжївЊГЩЗжгаN2ЁЂCO2 КЭ (ЬюЛЏбЇЪН)ЁЃ
ЃЈ2ЃЉвбжЊЃКЂйFe2O3 (s)+3C(s)=2Fe(s)+3CO(g) ІЄH=+494kJЁЄmol-1
ЂкCO(g)+O2(g)=CO2(g) ІЄH=-283kJЁЄmol-1
ЂлC(s)+O2(g)=CO(g) ІЄH=-110kJЁЄmol-1
дђЗДгІFe2O3 (s)+3 C(s)+ O2(g)=2Fe(s)+3CO2 (g) ЕФІЄH= kJЁЄmol-1ЁЃРэТлЩЯЗДгІ ЗХГіЕФШШСПзувдЙЉИјЗДгІ ЫљашЕФШШСПЃЈЬюЩЯЪіЗНГЬЪНађКХЃЉ
ЃЈ3ЃЉгаШЫЩшМЦГіЁАЖўВНШлШкЛЙдЗЈЁБСЖЬњЙЄвеЃЌЦфСїГЬШчЭМ(b)ЫљЪОЃЌЦфжаЃЌЛЙдЪњТЏЯрЕБгкИпТЏЕФ
ВПЗжЃЌжївЊЗДгІЕФЛЏбЇЗНГЬЪНЮЊ ЃЛШлШкдьЦјТЏЯрЕБгкИпТЏЕФ ВПЗжЁЃ
ЃЈ4ЃЉЬњПѓЪЏжаГЃКЌгаСђЃЌЪЙИпТЏЦјжаЛьгаSO2 ЮлШОПеЦјЃЌЭбSO2 ЕФЗНЗЈЪЧ ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП120ЁцЁЂ101.3 kPaЃЌМзЭщЃЈCH4ЃЉКЭЙ§СПЕФO2ЕФЛьКЯЮяЃЌгУЕчЛ№ЛЈв§ШМЃЈCH4+2O2=CO2+2H2OЃЉКѓЃЌЛжИДЕНдРДЕФЮТЖШКЭбЙЧПЃЌВтЕУЗДгІКѓЦјЬхУмЖШЮЊЯрЭЌЬѕМўЯТH2УмЖШЕФ15БЖЃЌдђдЛьКЯЦјЬхжаМзЭщКЭбѕЦјЕФЬхЛ§БШЮЊЃЈ ЃЉ
A. 2ЁУ1B. 1ЁУ2C. 1ЁУ7D. 7ЁУ1
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com