
【题目】把图2的碎纸片补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平)。下列对该反应的说法不正确的是

A. IO4﹣作氧化剂
B. 若有1 mol Mn2+参加反应转移5mol电子
C. 还原剂与氧化剂的物质的量之比为2:5
D. 配平后H+、Mn2+的化学计量数分别为4、2
【答案】D
【解析】
Mn2+作反应物,则MnO4-作生成物,化合价升高,因此IO4-作反应物,IO3-作生成物,H+作生成物,则H2O作反应物,因此反应方程式为:Mn2++IO4-+H2O→H++MnO4-+IO3-,根据化合价的升降法配平,2Mn2++5IO4-+3H2O=2MnO4-+5IO3-+6H+,据此解答。
A、根据上述分析IO4-化合价降低,作氧化剂,A正确;
B、根据离子反应方程式,消耗2molMn2+转移电子10mol,则消耗1molMn2+转移电子5mol,B正确;
C、根据反应方程式,还原剂与氧化剂的物质的量之比为2:5,C正确;
D、根据反应方程式,H+的系数为6,D错误。
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定

取0.0100 mol·Lˉ1的AgNO3标准溶液装入滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E) 反映溶液中c(Iˉ)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
请回答:
(1)①实验(一) 中的仪器名称:仪器A_________, 仪器 B_________。
②该次滴定终点时用去AgNO3溶液的体积为_____mL,计算得海带中碘的百分含量为_______%。
(2)①步骤X中,萃取后分液漏斗内观察到的现象是_______________。
②下列有关步骤Y的说法,正确的是___________________。
A.应控制NaOH溶液的浓度和体积
B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以由乙醇代替
③实验(二) 中操作Z的名称是______________________。
(3)方案甲中采用蒸馏不合理,理由是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是
A. 原子数目相等的三种气体,质量最大的是Z
B. 同温同压下,同质量的三种气体,气体密度最小的是X
C. 若一定条件下,三种气体体积均为2.24 L,则它们的物质的量一定均为0.1 mol
D. 同温下,体积相同的两容器分别充2 g Y气体和1 g Z气体,则其压强比为2︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 加水稀释0.01 mol·L-1的CH3COOH溶液,溶液中c(OH-)减小
B. 室温时,0.1 mol·L-1的某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4
C. 氨水加水稀释后,溶液中![]() 的值增大
的值增大
D. 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离NaCl和BaCl2两种固体混合物,回答下列问题:
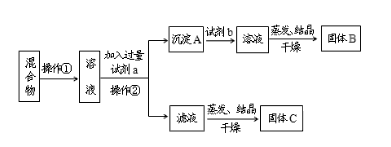
供选试剂:Na2CO3溶液、Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作②的名称是_____。
(2)试剂a是____(填化学式,下同),试剂b是___,固体B是____。
(3)加入试剂a、b分别所发生的化学反应方程式为____、____。
(4)该方案能否达到实验目的___。若不能,应如何改进(若能,此问不用回答)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四瓶贴有甲、乙、丙、丁标签的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液。现进行如下实验,并记录部分现象(如图):

据此完成下列回答:
(1)写出各物质的化学式:
甲:______________乙:_______________丁:________________;
(2)写出下列反应的离子方程式:
甲+乙:________________________________,
沉淀a+溶液b:________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在101 kPa时,H2在1 mol O2中完全燃烧生成2 mol液态水,放出571.6 kJ的热量,表示H2燃烧热的热化学方程式为__________________________。
(2)1.00 L 1.00 mol·L-1硫酸与2.00L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ的热量,该反应的中和热为表示其中和热的热化学方程式为________________。
(3)0.3 mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649. 5 kJ热量,其热化学方程式为________________________;又已知H2O(l)===H2O(g) ΔH=+44 kJ·mol-1,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 H 是一种抗病毒药物,在实验室中利用芳香烃 A 制备 H 的流程如下图所示(部分反应条件已略去):

己知:①有机物 B 苯环上只有两种不同环境的氢原子;
②两个羟基连在同一碳上不稳定,易脱水形成羰基或醛基;
③ RCHO + CH3CHO ![]() RCH=CHCHO + H2O;
RCH=CHCHO + H2O;
④
(1)有机物 B 的名称为_____。
(2)由 D 生成 E 的反应类型为___________ , E 中官能团的名称为_____。
(3)由 G 生成 H 所需的“一定条件” 为_____。
(4)写出 B 与 NaOH 溶液在高温、高压下反应的化学方程式:_____。
(5)F 酸化后可得 R, X 是 R 的同分异构体, X 能发生银镜反应,且其核磁共振氢谱显示有 3 种不同化学环境的氢,峰面积比为 1:1:1,写出 1 种符合条件的 X 的结构简式:___。
(6)设计由![]() 和丙醛合成
和丙醛合成![]() 的流程图:__________________________(其他试剂任选)。
的流程图:__________________________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器里进行如下可逆反应:S2Cl2(橙黄色液体)+Cl2(气)![]() 2SCl2(鲜红色液体) ΔH=-61. 16 kJ·mol-1。下列说法正确的是
2SCl2(鲜红色液体) ΔH=-61. 16 kJ·mol-1。下列说法正确的是
A. 增大压强,平衡常数将增大
B. 达到平衡时,单位时间里消耗n mol S2Cl2的同时也生成n mol Cl2
C. 达到平衡时,若升高温度,氯气的百分含量减小
D. 加入氯气,平衡向正反应方向移动,氯气的转化率一定升高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com