
【题目】一定条件下,在密闭容器里进行如下可逆反应:S2Cl2(橙黄色液体)+Cl2(气)![]() 2SCl2(鲜红色液体) ΔH=-61. 16 kJ·mol-1。下列说法正确的是
2SCl2(鲜红色液体) ΔH=-61. 16 kJ·mol-1。下列说法正确的是
A. 增大压强,平衡常数将增大
B. 达到平衡时,单位时间里消耗n mol S2Cl2的同时也生成n mol Cl2
C. 达到平衡时,若升高温度,氯气的百分含量减小
D. 加入氯气,平衡向正反应方向移动,氯气的转化率一定升高
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】把图2的碎纸片补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平)。下列对该反应的说法不正确的是

A. IO4﹣作氧化剂
B. 若有1 mol Mn2+参加反应转移5mol电子
C. 还原剂与氧化剂的物质的量之比为2:5
D. 配平后H+、Mn2+的化学计量数分别为4、2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请回答有关问题:

(1)⑤和⑧的元素符号是________和________(填写元素符号,下同);
(2)表中最活泼的金属是________,非金属最强的元素是________;
(3)⑥的最高正价是________。
(4)⑦和⑩单质氧化性________强(填写元素符号);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯化亚铁的熔点674℃、沸点1023℃;三氯化铁在300℃以上易升华,易溶于水并且有强烈的吸水性。在500℃条件下氯化亚铁与氧气可能发生多种反应,反应之一为:12FeCl2 +3O2![]() 2Fe2O3 +8FeCl3。某研究小组选用以下装置(夹持装置省略,装置可重复选用)进行反应的探究。回答下列问题:
2Fe2O3 +8FeCl3。某研究小组选用以下装置(夹持装置省略,装置可重复选用)进行反应的探究。回答下列问题:


(1)装置的合理连接顺序为A、 、D,其中E装置U形管左边设计为粗导管的目的是 。
(2)A装置中发生反应的化学方程式为 。
(3)反应过程发现,装置B中除生成红棕色固体外,还观察到黄绿色气体,生成该气体的化学方程式为 。
(4)待B中充分反应后,停止加热后,还需持续通氧气至 。
(5)设计实验:
①利用E装置U形管里的固体验证Fe(OH)3是弱碱: 。
②测定装置B的残留固体中铁元素的质量分数: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向分别含SO32-、Fe2+、Br-、I-各0.1mol的溶液中,通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量关系图正确的是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X可用于合成Y.下列有关X、Y的说法正确的是( )
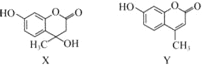
A. X分子中所有原子可能在同一平面上
B. X在一定条件下可以发生消去反应
C. Y与足量H2的加成产物中不含手性碳原子
D. X、Y与足量浓溴水反应的类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行的反应:N2 + 3H22NH3,下列说法正确的是
A. 降低温度能加快逆反应速率
B. 保持体积不变充入N2,能加快反应速率
C. 达到平衡时,反应速率:v(正) =v(逆)=0
D. 达到平衡时,N2和H2的转化率可能达到100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K4[Fe(CN)6]可用于生产油漆、药物等。
(1)Fe2+的核外电子排布式为_____。
(2)CN﹣中C原子轨道的杂化类型为_____。与CN﹣互为等电子体的一种分子的结构式为_____。
(3)[Cu(H2O)4]2+结构示意图如图所示。[Fe(CN)6]4﹣结构示意图如图所示,请在图中相应位置补填配体_________。
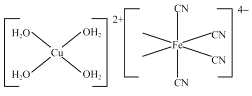
(4)已知3K4Fe(CN)6![]() 12KCN+Fe3C+3C+(CN)2↑+2N2↑.(CN)2分子中σ键与π键的数目比n(σ):n(π)=_____。
12KCN+Fe3C+3C+(CN)2↑+2N2↑.(CN)2分子中σ键与π键的数目比n(σ):n(π)=_____。
(5)铁触媒是合成氨反应的催化剂,其表面存在氮原子。氮原子在铁表面上的单层附着局部示意如图所示。则铁表面上氮原子与铁原子的数目比为_____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com