
����Ŀ��(1)��101 kPaʱ��H2��1 mol O2����ȫȼ������2 molҺ̬ˮ���ų�571.6 kJ����������ʾH2ȼ���ȵ��Ȼ�ѧ����ʽΪ__________________________��
(2)1.00 L 1.00 mol��L��1������2.00L 1.00 mol��L��1 NaOH��Һ��ȫ��Ӧ���ų�114.6 kJ���������÷�Ӧ���к���Ϊ��ʾ���к��ȵ��Ȼ�ѧ����ʽΪ________________��
(3)0.3 mol��̬����ȼ��������(B2H6)��������ȼ�գ����ɹ�̬�����������Һ̬ˮ���ų�649. 5 kJ���������Ȼ�ѧ����ʽΪ________________________������֪H2O(l)===H2O(g)����H����44 kJ��mol��1����11.2L(��״��)��������ȫȼ��������̬ˮʱ�ų���������________kJ��
���𰸡�H2(g)��1/2O2(g)===H2O(l)����H����285.8 kJ��mol��1 1/2 H2SO4(aq)��NaOH(aq)===1/2Na2SO4(aq)��H2O(l)����H����57.3 kJ��mol��1 B2H6(g)��3O2(g)===B2O3(s)��3H2O(l)����H����2 165 kJ��mol��1 1 016.5
��������
(1) ȼ������ָ��101 kPaʱ��1mol��ȼ����ȫȼ�������ȶ���������ʱ�ķ�Ӧ�ȡ�����֪��101 kPaʱ��2molH2��1 mol O2����ȫȼ������2 molҺ̬ˮ���ų�571.6 kJ������������H2ȼ���ȵ��Ȼ�ѧ����ʽΪH2(g)��1/2O2(g) =H2O(l)����H����285.8 kJ��mol��1���𰸣�H2(g)��1/2O2(g)=H2O(l)����H����285.8 kJ��mol��1��
��2���кͷ�Ӧ�ķ�Ӧ��������1molҺ̬H2OΪ������1.00 L 1.00 mol��L��1������2.00L 1.00 mol��L��1 NaOH��Һ��Ӧ����2molҺ̬H2O�ų�114.6 kJ���������к��Ȼ�ѧ����ʽΪ1/2 H2SO4(aq)��NaOH(aq)=1/2Na2SO4(aq)��H2O(l)����H����57.3 kJ��mol��1�𰸣�1/2 H2SO4(aq)��NaOH(aq)=1/2Na2SO4(aq)��H2O(l)����H����57.3 kJ��mol��1 ��
(3)1molB2H6(g)��ȫȼ�գ�����Һ̬ˮ�ų�������Ϊ649. 5 kJ /0.3 mol=2165kJ ������Ȼ�ѧ����ʽΪB2H6(g)��3O2(g)=B2O3(s)��3H2O(l)����H����2 165 kJ��mol��1������Ӧ���ɵ�3molH2O(l)ȫ��ת��Ϊ��̬ˮ��������������44 kJ��mol��1![]() kJ��11.2L(��״��)������Ϊ0.5mol,��0.5mol B2H6(g)��ȫȼ��������̬ˮʱ�ų�������Ϊ(2 165 -
kJ��11.2L(��״��)������Ϊ0.5mol,��0.5mol B2H6(g)��ȫȼ��������̬ˮʱ�ų�������Ϊ(2 165 -![]() )
)![]() 0.5/1= 1 016.5kJ���𰸣�B2H6(g)��3O2(g)=B2O3(s)��3H2O(l)����H����2 165 kJ��mol��1 �� 1 016.5��
0.5/1= 1 016.5kJ���𰸣�B2H6(g)��3O2(g)=B2O3(s)��3H2O(l)����H����2 165 kJ��mol��1 �� 1 016.5��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���ų��ķ�Һ��Ҫ��������п����������Ϊ�˴��л��ս�����������п��ij��ѧ��ѧ����С����������µ�ʵ�鲽�裺

(1)X��____________��Y��____________ (д��ѧʽ����ͬ)��
(2)����A����ҺB��C����Ҫ�ɷ֣�A______________��B______________��C______________��
(3)Z�����еIJ�����__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��úȼ���ŷŵ���������SO2��NOx���γ����ꡢ��Ⱦ����������NaClO2��Һ��Ϊ���ռ���ͬʱ���������������������ش��������⣺
��1�� NaClO2�Ļ�ѧ����Ϊ_______��
��2���ڹ��ݷ�Ӧ����ͨ�뺬�к���SO2��NOx����������Ӧ�¶�Ϊ323 K��NaClO2��ҺŨ��Ϊ5��103mol��L1����Ӧһ��ʱ�����Һ������Ũ�ȵķ���������±���
���� | SO42 | SO32 | NO3 | NO2 | Cl |
c/��mol��L1�� | 8.35��104 | 6.87��106 | 1.5��104 | 1.2��105 | 3.4��103 |
��д��NaClO2��Һ������������Ҫ��Ӧ�����ӷ���ʽ__________������ѹǿ��NO��ת����______���������������������������������
���������շ�Ӧ�Ľ��У����ռ���Һ��pH��______ ���������������������������������
����ʵ������֪������Ӧ����______������Ӧ���ʣ���������������С��������ԭ���dz���SO2��NO�������еij�ʼŨ�Ȳ�ͬ����������___________��
��3���ڲ�ͬ�¶��£�NaClO2��Һ���������ķ�Ӧ�У�SO2��NO��ƽ���ѹpx��ͼ��ʾ��
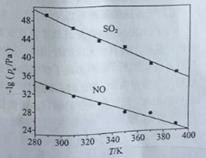
����ͼ������֪����Ӧ�¶����ߣ�����������Ӧ��ƽ�ⳣ����______________��������������������������С������
����ӦClO2+2SO32===2SO42+Cl��ƽ�ⳣ��K����ʽΪ___________��
��4���������NaClO��Ca��ClO��2���NaClO2��Ҳ�ܵõ��Ϻõ���������Ч����
���ӻ�ѧƽ��ԭ��������Ca��ClO��2���NaClO���е��е���_______��
����֪���з�Ӧ��
SO2��g��+2OH��aq�� ===SO32��aq��+H2O��l�� ��H1
ClO��aq��+SO32��aq�� ===SO42��aq��+Cl��aq�� ��H2
CaSO4��s�� ===Ca2+��aq��+SO42��aq�� ��H3
��ӦSO2��g��+ Ca2+��aq��+ ClO��aq�� +2OH��aq�� ="==" CaSO4��s�� +H2O��l�� +Cl��aq������H=______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ2����ֽƬ���䵽ͼ1�У��ɵõ�һ��������������ԭ��Ӧ�����ӷ���ʽ��δ��ƽ�������жԸ÷�Ӧ��˵������ȷ����

A. IO4����������
B. ����1 mol Mn2+�μӷ�Ӧת��5mol����
C. ��ԭ���������������ʵ���֮��Ϊ2��5
D. ��ƽ��H+��Mn2+�Ļ�ѧ�������ֱ�Ϊ4��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2 L�ܱ������У�800��ʱ��Ӧ2NO(g)��O2(g) ![]() 2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯���±���
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯���±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)д���÷�Ӧ��ƽ�ⳣ������ʽ��K��________����֪��K(300��)>K(350��)���÷�Ӧ��________��Ӧ(����ȡ������ȡ�)��
(2)��ͼ�б�ʾNO2�ı仯��������___����O2��Ũ�ȱ仯��ʾ��0��2 s�ڸ÷�Ӧ��ƽ������v��__________��

(3)��˵���÷�Ӧ�Ѿ��ﵽƽ��״̬������____��
a��v(NO2)��2v(O2) b��������ѹǿ���ֲ���
c��v��(NO)��2v��(O2) d�����������ʵ��ܶȱ��ֲ���
(4)��ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�������____��
a����ʱ�����NO2���� b���ʵ������¶�
c������O2��Ũ�� d��ѡ���Ч�Ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ�ɻ���Ϊһ����Դ��- ������Դ��ֱ�Ӵ���Ȼ��ȡ�õ���Դ��Ϊһ����Դ��һ����Դ�����ӹ���ת���õ�����Դ��Ϊ:������Դ��������Դ������һ����Դ����
A. ����B. ����C. ����D. ˮú��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ���ܡ�̫���ܵ�����һ����Դ
B. X![]() Y��Z����Ӧ���������淴Ӧ��Ȼ����
Y��Z����Ӧ���������淴Ӧ��Ȼ����
C. ��ѧ��Ӧ���ʱ���HԽ������ʾ����Խ��
D. ϡ��Һ��������кͷ�Ӧ����1 mol H2Oʱ���Ȳ�һ��Ϊ57.3 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ���֣���ش��й����⣺

��1���ݺ͢��Ԫ�ط�����________��________(��дԪ�ط��ţ���ͬ)��
��2����������õĽ�����________���ǽ�����ǿ��Ԫ����________��
��3�������������________��
��4���ߺ͢ⵥ��������________ǿ(��дԪ�ط���)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com