
����Ŀ����2 L�ܱ������У�800��ʱ��Ӧ2NO(g)��O2(g) ![]() 2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯���±���
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯���±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)д���÷�Ӧ��ƽ�ⳣ������ʽ��K��________����֪��K(300��)>K(350��)���÷�Ӧ��________��Ӧ(����ȡ������ȡ�)��
(2)��ͼ�б�ʾNO2�ı仯��������___����O2��Ũ�ȱ仯��ʾ��0��2 s�ڸ÷�Ӧ��ƽ������v��__________��

(3)��˵���÷�Ӧ�Ѿ��ﵽƽ��״̬������____��
a��v(NO2)��2v(O2) b��������ѹǿ���ֲ���
c��v��(NO)��2v��(O2) d�����������ʵ��ܶȱ��ֲ���
(4)��ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�������____��
a����ʱ�����NO2���� b���ʵ������¶�
c������O2��Ũ�� d��ѡ���Ч�Ĵ���
���𰸡�c2(NO2)/c2(NO)c(O2) ���� b 1.5��10��3 mol��L��1��s��1 bc c
��������
(1) 2NO(g)��O2(g) ![]() 2NO2(g)��Ӧ��ƽ�ⳣ��K=c2(NO2)/[c2(NO)
2NO2(g)��Ӧ��ƽ�ⳣ��K=c2(NO2)/[c2(NO)![]() c(O2)],��Ϊ����ƽ�������ȷ�Ӧ�������,��֪��K(300��)>K(350��)���¶�Խ��ƽ�ⳣ��ԽС������ƽ��������У��������ӦΪ���ȷ�Ӧ���ʴ�Ϊ��c2(NO2)/c2(NO)c(O2)�����ȣ�
c(O2)],��Ϊ����ƽ�������ȷ�Ӧ�������,��֪��K(300��)>K(350��)���¶�Խ��ƽ�ⳣ��ԽС������ƽ��������У��������ӦΪ���ȷ�Ӧ���ʴ�Ϊ��c2(NO2)/c2(NO)c(O2)�����ȣ�
(2)�ɱ������ݿ�֪��3s��ʼ,NO�����ʵ���Ϊ0.007mol,���ٱ仯,3sʱ��Ӧ��ƽ��,NO2�Dz���,�淴Ӧ����Ũ��������ƽ��ʱNOŨ�ȵı仯����c(NO)=(0.02mol0.007mol)/2L=0.0065mol/L,����ͼ�б�ʾNO2�仯��������b��2s����NO��ʾ��ƽ����Ӧ����v(NO)=��n/V��t=(0.02mol0.008mol)/(2L![]() 2s)=3.0��103molL1s1,����֮�ȵ��ڻ�ѧ������֮��,����v(O2)=1/2v(NO)=1/2��3.0��103molL1s1=1.5��103molL1s1.�ʴ�Ϊ��b;1.5��103molL1s1��
2s)=3.0��103molL1s1,����֮�ȵ��ڻ�ѧ������֮��,����v(O2)=1/2v(NO)=1/2��3.0��103molL1s1=1.5��103molL1s1.�ʴ�Ϊ��b;1.5��103molL1s1��
(3)aδָ����������,������ʾͬһ����Ӧ����,v(NO2)��ʼ����Ϊv(O2)��2��������˵���ﵽƽ�⣬��a����b����������䣬�淴Ӧ���У���Ӧ��������ܵ����ʵ����ڼ�С��������ѹǿ��С����������ѹǿ���ֲ��䣬˵����Ӧ����ƽ�⣬��b��ȷ��c��ͬ���ʱ�ʾ����,����ƽ��ʱ,��������֮�ȵ��ڻ�ѧ������֮��,V��(NO):��(O2)=2:1,��V��(NO)=2v��(O2)����c��ȷ��d.�����������������䣬�����ݻ�Ϊ��ֵ�������ܶ���ʼ���ղ��䣬����˵���ﵽƽ�⣬��d���ʴ�Ϊ��bc��
(4)a.��ʱ�����NO2����ƽ�������ƶ�������Ӧ���ʼ�С����a����b.�ʵ������¶ȣ���Ӧ��������ƽ�����淴Ӧ�����ƶ�����b����c.����O2��Ũ�ȷ�Ӧ���������Ҹ÷�Ӧ������Ӧ�����ƶ�����c��ȷ��d.ѡ���Ч����������Ӧ���ʣ���ƽ�ⲻ�ƶ�����d����;�ʴ�Ϊ��c��


 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£����з�Ӧ��ˮ���������淴Ӧʱ��ı仯���Ʒ�����ͼ10 ����

A. CO2(g)��2NH3(g)![]() CO(NH2)2(s)��H2O(g)����H��0
CO(NH2)2(s)��H2O(g)����H��0
B. CO2(g)��H2(g)![]() CO(g)��H2O(g)����H��0
CO(g)��H2O(g)����H��0
C. CH3CH2OH (g)![]() CH2=CH2(g)��H2O(g)����H��0
CH2=CH2(g)��H2O(g)����H��0
D. 2C6H5CH2CH3(g)��O2(g)![]() 2 C6H5CH=CH2(g)��2H2O(g)����H��0
2 C6H5CH=CH2(g)��2H2O(g)����H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص������Һ��˵����ȷ������ ��
A. ��0.1 molL-1CH3COOH��Һ�м�������ˮ����Һ�� ��С
��С
B. ��CH3COONa��Һ��20��������30������Һ��  ����
����
C. �������м��백ˮ�����ԣ���Һ�� >1
>1
D. ��AgCl��AgBr�ı�����Һ�м�������AgNO3��Һ�� ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�������ʵ�鷽�����Է���NaCl��BaCl2���ֹ�������ش��������⣺
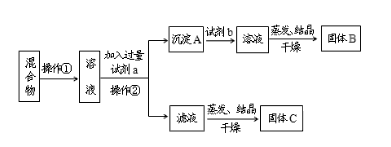
��ѡ�Լ���Na2CO3��Һ��Na2SO4��Һ��K2CO3��Һ��K2SO4��Һ������
��1�������ڵ�������_____��
��2���Լ�a��____(�ѧʽ����ͬ)���Լ�b��___������B��____��
��3�������Լ�a��b�ֱ��������Ļ�ѧ��Ӧ����ʽΪ____��____��
��4���÷����ܷ�ﵽʵ��Ŀ��___�������ܣ�Ӧ��θĽ�(���ܣ����ʲ��ûش�)____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ1��ͭпԭ���ʾ��ͼ��ͼ2�У�x���ʾʵ��ʱ���������ĵ��ӵ����ʵ�����y���ʾ��������

A. ͭ�������� B. c(Zn2��) C. c(H��) D. c(SO42-) -
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��101 kPaʱ��H2��1 mol O2����ȫȼ������2 molҺ̬ˮ���ų�571.6 kJ����������ʾH2ȼ���ȵ��Ȼ�ѧ����ʽΪ__________________________��
(2)1.00 L 1.00 mol��L��1������2.00L 1.00 mol��L��1 NaOH��Һ��ȫ��Ӧ���ų�114.6 kJ���������÷�Ӧ���к���Ϊ��ʾ���к��ȵ��Ȼ�ѧ����ʽΪ________________��
(3)0.3 mol��̬����ȼ��������(B2H6)��������ȼ�գ����ɹ�̬�����������Һ̬ˮ���ų�649. 5 kJ���������Ȼ�ѧ����ʽΪ________________________������֪H2O(l)===H2O(g)����H����44 kJ��mol��1����11.2L(��״��)��������ȫȼ��������̬ˮʱ�ų���������________kJ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʢ�(2��3-���ⱽ���)��һ����Ҫ�ľ�ϸ����ԭ��,��ϳɵIJ����������£�

����������ȷ����
A. ���ʢ�ĺ˴Ź�������ͼ��ʾ�����ֲ�ͬ��������
B. ���ʢ���NaOH����Һ�м��ȿɷ�����ȥ��Ӧ
C. ���ʢ�������ԭ�ӿ���λ��ͬһƽ����
D. ���ʢ�������H2�ӳ����ò����������2������̼ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������M���C������أ���ͼ������ԭ���á������ܶȸߵ��ŵ㣬������Ϊ����Դ�������ƶ��豸�ĵ�Դ�������طŵ���ܷ�Ӧ����ʽΪ��4M+nO2+2nH2O=4M(OH) n����֪����ص������۱�������ָ��λ�����ĵ缫�������������ͷų��������ܡ�����˵������ȷ����

A. ���ö�缫��Ŀ������ߵ缫��������Һ�ĽӴ��������������������ɢ���缫����
B. �Ƚ�Mg��Al��Zn���ֽ����C������أ�Al�C������ص����۱��������
C. M�C������طŵ���̵�������Ӧʽ��4Mn++nO2+2nH2O+4ne�C=4M(OH)n
D. ��M�C��������У�Ϊ��ֹ����������Mg(OH)2���˲������Ե���ʼ������ӽ���Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Т�0.112Lˮ����3.01��1023���Ȼ�����ӣ���13.6 g H2S���壻��0.2 mol���������ж����������ʵĹ�ϵ��С����������ȷ���ǣ� ��
A. ���������٢ۢڢ�B. �ܶȣ��ܢ٢ۢ�
C. �����٢ܢ�D. ��ԭ�������ڢܢۢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com