
科目: 来源: 题型:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |

查看答案和解析>>
科目: 来源: 题型:
 甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段制备甲醇:
甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段制备甲醇:| 10min | 20min | 30min | 40min | 50min | 60min | |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
| 1 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
 有两个实验小组的同学探究一氧化碳、二氧化硫与过氧化钠的反应.请回答下列问题:
有两个实验小组的同学探究一氧化碳、二氧化硫与过氧化钠的反应.请回答下列问题:
| ||
| △ |
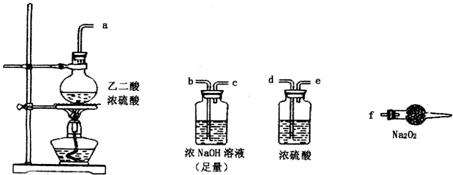
查看答案和解析>>
科目: 来源: 题型:

| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.160 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | |||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 六种元素中原子半径最大 | 次外层电子数是最外层电子数的4倍 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com