
科目: 来源: 题型:
【题目】有一化合物X,其水溶液为浅绿色,可发生如下的转化关系(部分反应物、生成物已略)。其中B、D、E、F均为无色气体,M、L为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和M反应可放出大量的热。请回答下列问题:
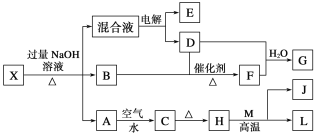
(1)B的电子式为____________。
(2)电解混合液时阳极反应式为_______________________。
(3)写出L长期放置在潮湿空气中的腐蚀原理:
负极:___________________________________。
正极:___________________________________。
总反应:______________________________________________________。
(4)已知a g E气体在D中完全燃烧生成稳定的化合物时,放出b kJ的热量,写出E气体燃烧热的热化学方程式为___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组在T1温度下,容积为1 L的恒容密闭容器中,同时通入0.1 mol CO(g)和0.1 mol H2O(g),发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=a kJ· mol-1。测得CO2的物质的量浓度随时间的变化关系如图所示。
CO2(g)+H2(g) △H=a kJ· mol-1。测得CO2的物质的量浓度随时间的变化关系如图所示。
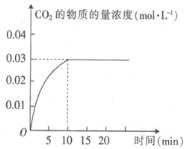
(1)0~10min内,CO的平均反应速率为_______________。
(2)T1温度下,该反应的平衡常数K为________(用分数表示)。
(3)①已知:
I.H2的燃烧热△H=-285.8 kJ· mol-1;
II.CO的燃烧热△H=-283 kJ· mol-1;
III.H2O(g)=H2O(l) △H=-44 kJ· mol-1。
则a=_______。
②反应达到平衡后,下列措施能使平衡向正反应方向移动的是__________(填字母)。
A 升高温度 B 增大压强 C 通入H2O(g) D 移走CO2(g)
(4)T1温度下,某时刻另一实验小组测得反应容器中有关数据为c(CO)=0.6 mol·L-1、c(H2O)=1.6 mol·L-1,c(H2)=0.4 mol·L-1,c(CO2)=0.4 mol·L-1,则该反应在下-时刻将____(填“向正反应方向进行”“向逆反应方向进行”或“达到平衡”),判断依据是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。在体积为2L的密闭容器中,充入2molCO2和9molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示:
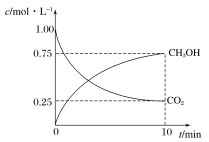
(1)该反应的平衡常数K表达式为________。
(2)0~10min时间内,该反应的平均反应速率v(H2O)=_______,H2的转化率为_______。
(3)下列叙述中,能说明反应已达到化学平衡状态的是________(填字母)。
A.容器内CO2、H2、CH3OH、H2O(g)的浓度之比为1∶3∶1∶1
B.v正(CO2)∶v逆(H2)=1∶3
C.平衡常数K保持不变
D.混合气体的平均相对分子质量保持不变
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH1=-1452.8kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各项正确的是( )
A.钠与水反应的离子方程式:Na+H2O=Na++OH-+H2↑
B.铁与水蒸气反应的化学方程式:3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
C.镁、铝与沸水不可能反应
D.钠和硫酸铜溶液反应的离子方程式:2Na+Cu2+=2Na++Cu
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度、压强下,向密闭容器中投入一定量N2和H2,发生反应:N2+3H2![]() 2NH3 △H<0。
2NH3 △H<0。
(1)反应开始阶段,v(正)_______(填“>”“<”或“=”)v(逆),随后v(正)________逐渐(填“增大”或“减小”,下同),v(逆)逐渐_______,反应达到平衡时,v(正)_______(填“>”“<”或“=”)v(逆)。
(2)达到平衡后,若正反应速率用v(N2)表示,逆反应速率用v’(H2)表示,则v(N2)=____v’(H2)。
(3)下列措施中能加快反应速率并提高氢气的转化率的是_______(填字母)。
A 其他条件不变时,压缩容器体积 B 其他条件不变时,升高反应体系温度
C 使用合适的催化剂 D 保持容器体积不变,充入一定量的氮气
(4)实际生产中往往需要将温度控制在一个合适的范围,分析温度不宜过高也不宜过低的原因是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】向20mLNaOH溶液中逐滴加入![]() 醋酸溶液,滴定曲线如图所示。下列判断正确的是
醋酸溶液,滴定曲线如图所示。下列判断正确的是
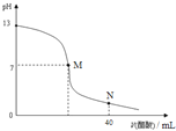
A.在M点,两者恰好反应完全
B.滴定前,酸中![]() 等于碱中
等于碱中![]()
C.NaOH溶液的物质的量浓度为![]()
![]()
D.在N点,c(CH3COO-)> c(Na+)>c(H+)> c(CH3COOH)
查看答案和解析>>
科目: 来源: 题型:
【题目】绿色化学是指从技术、经济上设计可行的化学反应,尽可能减少对环境的负作用。下列 化学反应不符合绿色化学概念的是( )
A. 消除硫酸厂尾气排放:SO2+2NH3+H2O=(NH4)2SO3
B. 消除制硝酸厂的氮氧化物污染:NO2+NO+2NaOH=2NaNO2+H2O
C. 制 CuSO4:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D. 制 CuSO4:2Cu+O2![]() 2CuO,CuO+H2SO4(稀)=CuSO4+H2O
2CuO,CuO+H2SO4(稀)=CuSO4+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】化学概念在逻辑上存在如图关系,对下列概念的说法正确的是( )

A. 化合物与氧化物属于交叉关系
B. 单质与非电解质属于包含关系
C. 溶液与分散系属于并列关系
D. 化合物与电解质属于包含关系
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL,溶液pH数值范围为___________,溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]___________(填“增大”“减小”“不变”或“不能确定”)。
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=___________。用pH试纸测定该氨水pH的操作方法为_______________________________________________________。
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=_______________________________,25 ℃时,氨水电离平衡常数约为___________。
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH4+)/c(NH3.H2O)___________(填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。
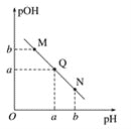
图中M、Q、N三点所示溶液呈中性的点是___________(填字母,下同)。
图中M、Q、N三点所示溶液中水的电离程度最大的点可能是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com