
科目: 来源: 题型:
【题目】298K时,向20mL浓度均为0.1mo1/L的MOH和NH3·H2O混合液中滴加0.1mol的CH3COOH溶液,测得混合液的电阻率(表示电阻特性的物理量)与加入CH3COOH溶液的体积(V)的关系如图所示。已知CH3COOH的Ka=1.8×10-5,NH3·H2O的Kb=1.8×10-5。下列说法错误的是( )
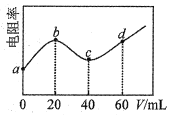
A.MOH是强碱
B.c点溶液中浓度:c(CH3COOH)<c(NH3·H2O)
C.d点溶液呈酸性
D.a→d过程中水的电离程度先增大后减小
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾是常见的水处理剂,工业上制备高铁酸钾有多种方法。某兴趣小组以铁屑为原料模拟制备高铁酸钾的流程如下:
(查阅资料)高铁酸钾呈紫红色,在酸性或中性溶液中快速产生O2。
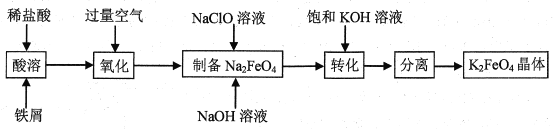
回答下列问题:
(1)“氧化”阶段通入空气作氧化剂,它比用氯气具有的优点是___。
(2)为了检验“氧化”过程中所得FeCl3溶液中是否还含有Fe2+,最佳的检验试剂是___(填标号)。
a.K3[Fe(CN)6]溶液 b.NaOH溶液 c.淀粉KI试纸
(3)请写出“制备”反应的离子方程式___。
(4)“转化”过程使用过量饱和KOH溶液的原因是___。
(5)“分离”过程获得K2FeO4晶体的系列操作是蒸发,结晶、过滤、洗涤、干燥,其中洗涤使用的最佳洗涤剂是___(填标号)。
a.冷水 b.冷的稀NaOH溶液 c.冷的浓KOH溶液
(6)电解法制备K2FeO4,操作简单,易于实验室制备原理如图所示,其中阳极的电极反应式是___。

(7)探究K2FeO4的性质。取电解后的紫红色溶液,加入稀盐酸,观察到溶液由紫红色逐渐变为黄色,并收集到黄绿色气体。甲同学认为:气体中一定含有Cl2;乙同学认为:气体中还可能含有___。请设计实验证明乙同学的猜测___。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以水钴矿(主要成分为Co2O3,还含Fe、A1、Mg、Ca、Si等元素)制备钴的氧化物,工艺如图所示。回答下列问题:

相关金属离子[co(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:

(1)水钴矿中的Fe、A1、Mg、Ca元素的存在形态为___(填“游离态”或“化合态”)。
(2)“酸溶”中Co2O3反应的离子方程式是___,滤渣1的成分可能是___。
(3)“氧化”中加Co2O3的作用是___。
(4)“调pH”为4.7-6之间,则滤渣2为___。
(5)已知Ksp(CaF2)=5.3×10-9,Ksp(MgF2)=5.2×10-12,“除杂”是为了除去Ca2+和Mg2+,此时先析出的沉淀是___(填化学式),过程中![]() 最大值为___(列出算式即可)。
最大值为___(列出算式即可)。
(6)实验室拟在空气中煅烧CoC2O4以探究其产物。实验时将13.23gCoC2O4放入___(填仪器名称)中,测得生成钴的某种氧化物7.23g和气体CO2。据此预测:该氧化物中Co化合价的可能情况是___,真实情况有待进一步查证。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是实验室研究潜水艇中供氧体系反应机理的装置图(夹持仪器略)。
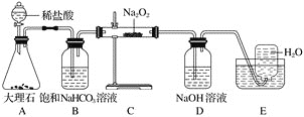
(1)A装置为CO2的发生装置,反应的离子方程式为____________________。
(2)B装置可除去A装置中可能挥发出的___________,反应的离子方程式为_______________。
(3)C装置为O2的发生装置,反应的化学方程式为__________________、________________。
(4)D装置可除去C装置中未反应的__________,反应的离子方程式为____________________。
(5)E装置为排水法收集O2的装置,检验所收集的气体为O2的方法为_____________________。
(6)C装置中固体由淡黄色完全变为白色,检验固体成分的实验方案为取少量C装置中反应后的固体溶于水,向溶液中滴入过量___溶液,若有白色沉淀生成,则证明固体中含有___;过滤,向滤液中滴入几滴酚酞溶液,若__且不褪色,则证明固体中含有__。
查看答案和解析>>
科目: 来源: 题型:
【题目】等质量的甲、乙、丙三种金属,分别与足量的溶质质量分数相同的稀硫酸完全反应后,都生成+2价的硫酸盐,其产生氢气的体积与反应时间的关系如图所示,则下列说法正确的是

A. 三种金属的活动性顺序为甲>乙>丙
B. 反应结束消耗硫酸的质量一定相同
C. 三种金属的相对原子质量是甲>乙>丙
D. 甲先反应完,乙最后反应完
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图像表示向AlCl3溶液中滴加NaOH溶液的过程中或向NaAlO2溶液中滴加稀盐酸的过程中Al3+与![]() 物质的量的变化曲线,实线表示Al3+物质的量的变化,虚线表示
物质的量的变化曲线,实线表示Al3+物质的量的变化,虚线表示![]() 物质的量的变化。其中正确的是( )
物质的量的变化。其中正确的是( )
A.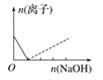 B.
B.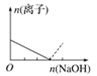 C.
C.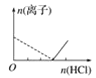 D.
D.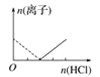
查看答案和解析>>
科目: 来源: 题型:
【题目】在严格无氧的条件下,碱与亚铁盐溶液反应生成白色胶状的 Fe(OH)2,在有氧气的情况下迅速 变为灰绿色,逐渐形成红褐色的氢氧化铁,故在制备过程中需严格无氧。现提供制备方法如下:
方法一:用 FeSO4 溶液与用不含 O2 的蒸馏水配制的 NaOH 溶液反应制备。
(1)配制 FeSO4 溶液时需加入铁粉的原因是_____;除去蒸馏水中溶解的 O2常采用_____的方法。
(2)生成白色 Fe(OH)2 沉淀的操作是用长滴管吸取不含 O2 的 NaOH 溶液,插入 FeSO4 溶液液面下,再挤出 NaOH 溶液。这样操作的理由是_____。
方法二:
在如图装置中,用 NaOH 溶液、铁屑、稀 H2SO4 等试剂制备。

(1)在试管Ⅰ里加入的试剂是_____;
(2)在试管Ⅱ里加入的试剂是_____;
(3)为了制得白色 Fe(OH)2 沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤 是_____。
(4)这样生成的 Fe(OH)2 沉淀能较长时间保持白色,其理由是_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁系元素是人体必需的微量元素,Fe3+可以与KSCN溶液、苯酚等发生显色作用。镁元素也是人体所必需的阳离子元素之一,它能够维持核酸结构的稳定性,调节机体免疫功能,对人体抵抗新冠病毒等病毒侵袭起着重要作用。
(1)Fe3+的基态核外电子排布式为____________________。
(2)与SCN互为等电子体且为非极性分子的化学式为_____________(任写一种)。
(3)普鲁士蓝俗称铁蓝,晶胞如图甲所示(K+未画出),平均每两个晶胞立方体中含有一个K+,又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为_________。
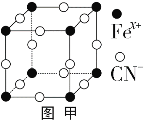
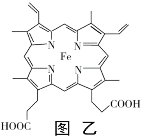
(4)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高3倍,在图乙中画出Fe2+与N原子间的化学键(若是配位键,需要用箭头加以表示)______________

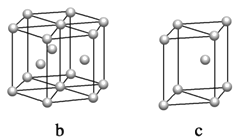
(5)镁单质晶体中原子的堆积模型如图,它的堆积模型名称为____________;晶胞是图中的_________________(填a、b或c);配位数是__________________;晶胞的体积是2acm3,镁单质的密度为ρg·cm-3,已知阿伏伏德罗常数为NA,则镁的摩尔质量的计算式是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。
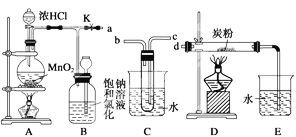
(1)C中试管中装有试剂水,要将C装置接入B和D之间,正确的接法是:a→___→___→d。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为____。为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是___。
(3)D处反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是___。
(4)用量筒量取20mLE中溶液,倒入分液漏斗中,然后再注入10mLCCl4,盖好玻璃塞(如图),振荡,静置于铁架台上,等分层后取上层液和下层液,再装入如图所示的烧杯中,能使有色布条褪色的是__(填“上层液”或“下层液”)。
(5)在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由___ ,并在方框中画出改进后的装置___。
查看答案和解析>>
科目: 来源: 题型:
【题目】向50 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应。下列说法正确的是( )
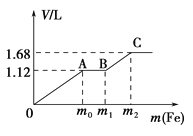
A. 开始时产生的气体为H2
B. AB段发生的反应为置换反应
C. 参加反应铁粉的总质量m2=5.6 g
D. 所用混合溶液中c(HNO3)=0.5 molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com