
科目: 来源: 题型:
【题目】某研究性学习小组设计用如图所示实验装置(夹持仪器省略)制取干燥的氨气并验证NH3具有还原性,请回答下列问题:
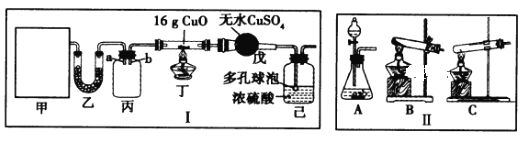
(1)实验室制备氨气有多种方法,现欲用NH4C1与Ca(OH)2反应制取NH3,则甲中的气体发生装置___________(从Ⅱ中选用);用浓氨水与生石灰反应也可制取NH3,反应的化学方程式为__________
(2)装置丙用于收集NH3,应将导管__________(填“a”或“b”)延长至集气瓶底部,装置乙中盛放的试剂为__________,装置己的作用为____________(答两点)。
(3)若装置丁中黑色固体变红,则装置戊中现象为_________
(4)研究小组的同学通过讨论、分析后认为充分反应后生成的红色固体可能是Cu或Cu2O或二者的混合物,通过查阅资料知:Cu2O+2H+=Cu+Cu2++H2O。为探究固体的成分,提出了如下两种方案。
I. 甲同学取少量红色固体与稀硝酸混合,最终得到蓝色溶液,由此推测红色产物中有Cu2O。
①你对甲同学实验设计的评价是__________(请给出必要的文字解释)。
②Cu2O与稀硝酸反应的离子方程式为_____________
Ⅱ.乙同学认为不需要借助任何化学试剂,只需要称量生成的红色固体的质量(设为xg)就能确定产物成分,当x取值范围为 _____时,表明产物中既有Cu,又有Cu2O。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势如图所示:
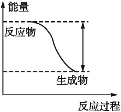
(1)该反应为_________(填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率增大,下列措施可行的是_________(填字母)。
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度 D.使用催化剂
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为:_________(填“正”或“负”)极,该极上发生的电极反应为:_________,外电路中电子移动方向为:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。

实验操作 | 实验现象 |
i.打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
ii.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
iii.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(1)C中产生的白色沉淀是______。
(2)甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2。
①乙同学认为不能得出此结论,对实验进行了改进:
打开弹簧夹,通入N2,待排净装置内空气后,关闭弹簧夹,再打开A中分液漏斗活塞,此操作的目的是_________________
②丙同学进行了进一步的改进:
在B和C之间增加盛放CCl4的洗气瓶D,丙同学的目的是______
③将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:
氧化性H2O2>SO2。试写出两者反应的化学方程式________________
(3)iii中滴入少量H2O2没有明显变化。提出假设:
观点1:H2O2的量少不能氧化Br-
观点2:B中有未反应H2SO3(或SO2)
为验证观点2,应进行的实验操作及现象是______。
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图:
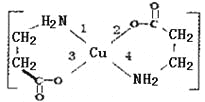
(1)基态Cu2+的最外层电子排布式为__。
(2)二甘氨酸合铜(II)中,第一电离能最大的元素与电负性最小的非金属元素可形成多种微粒,其中一种是5核10电子的微粒,该微粒的空间构型是__。
(3)lmol二甘氨酸合铜(II)含有的π键数目是__。
(4)二甘氨酸合铜(II)结构中,与铜形成的化学键中一定属于配位键的是__(填写编号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硒元素(Se)是第4周期ⅥA族元素,单质有红硒、黑硒和灰硒,灰硒是良好的半导体材料,硒最特殊的性质是在光照射下导电性可提高近千倍,可用于制造光电管。请回答下列问题:
(1)基态Se原子价电子的轨道表示式为__。
(2)As和Se是同一周期元素,As的第一电离能比Se大,原因是___。
(3)硒在空气中燃烧能生成SeO2,常温下,SeO2是易挥发的白色固体,熔点为340~350℃,315℃时升华,则SeO2固体是___晶体;写出一种与SeO2互为等电子体的阴离子的化学式__。
(4)H2SeO4和H2SO4相似,是一种不易挥发的强酸。SeO42-的空间构型为___,中心原子的杂化方式为___。
(5)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,Zn原子的配位数为___,若该晶胞密度为ρg·cm-3,硒化锌的摩尔质量为Mg·mol-1,用NA代表阿伏加德罗常数,则晶胞参数a(即晶胞的边长)为___nm。

查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,可逆反应mA(g)+nB(g)![]() pC(g)的平衡常数为K,下列对K的说法正确的是( )
pC(g)的平衡常数为K,下列对K的说法正确的是( )
A.K值越大,表明该反应越有利于C的生成
B.若缩小反应器的容积,能使平衡正向移动,则K增大
C.温度越高,K一定越大
D.如果m+n=p,则K=1
查看答案和解析>>
科目: 来源: 题型:
【题目】S4N4的结构如图:
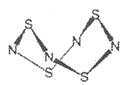
(1)S4N4的晶体类型是__。
(2)用干燥的氨作用于S2Cl2的CCl4,溶液中可制S4N4。化学反应方程为:6S2Cl2+16NH3=S4N4+S8+12NH4Cl
①上述反应过程中,没有破坏或形成的微粒间作用力是__。
a.离子键 b.极性键 c.非极性键 d.金属键 e.配位键 f.范德华力
②S2Cl2中,S原子轨道的杂化类型是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】对复杂的有机物结构可用“键线式”表示。如苯丙烯酸1—丙烯酯: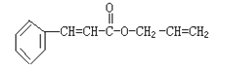 可简化为
可简化为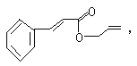 杀虫剂“阿乐丹”的结构表示为
杀虫剂“阿乐丹”的结构表示为 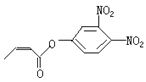 ,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
A.遇FeCl3溶液均显紫色B.均能发生银镜反应
C.均能与溴水发生反应D.均能与NaOH溶液发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )
A.单位时间生成nmol的A2同时生成nmol的AB
B.容器内的压强不随时间变化
C.单位时间生成2nmol的AB同时生成nmol的B2
D.单位时间生成nmol的A2同时生成nmol的B2
查看答案和解析>>
科目: 来源: 题型:
【题目】生产铅蓄电池时,在两极板上的铅、锑合金棚架上均匀涂上膏状的PbSO4,干燥后再安装,充电后即可使用,发生的反应是2PbSO4+2H2O![]() PbO2+Pb+2H2SO4。下列对铅蓄电池的说法错误的是( )
PbO2+Pb+2H2SO4。下列对铅蓄电池的说法错误的是( )
A.需要定期补充硫酸
B.工作时铅是负极,PbO2是正极
C.工作时负极上发生的反应是Pb-2e-+SO42-=PbSO4
D.工作时电解质溶液的密度减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com