
科目: 来源: 题型:
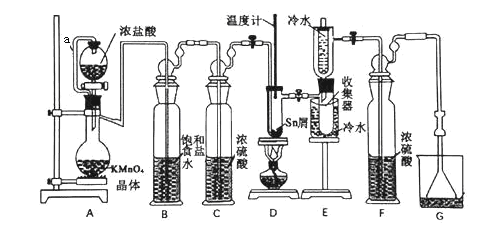
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点232℃)与Cl2反应制备SnCl4,装置如下图所示。
已知:①SnCl2、SnCl4有关物理性质如下表
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
②SnCl4遇水极易水解生成SnO2·xH2O。
回答下列问题:
(1)导管a的作用是__________,装置A中发生反应的离子方程式为_____________ 。
(2)当观察到装置F液面上方出现______ 现象时才开始点燃酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的有两点:加快氯气与锡反应和_________。
(3)若上述装置中缺少装置C(其它均相同),则D处具支试管中发生的主要副反应化学方程式为_______________________________。
(4)Cl2和Sn的反应产物有SnCl4和SnCl2,为了防止产品中带入过多的SnCl2,装置D可改为油浴加热来控制温度,该温度范围是________。
(5)制得的SnCl4产品中常含有SnCl2,可用如下方法测定产品纯度:先准确称量7.60g产品于锥形瓶中,再加过量的FeCl3溶液,发生反应:SnCl2+2FeCl3===SnCl4+2FeCl2,再用0.1000 mol·L—1 K2Cr2O7标准溶液滴定生成的Fe2+,此时还原产物为Cr3+,消耗标准溶液 20.00 mL,则SnCl4产品的纯度为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:

(1)浸锰过程中Fe2O3与SO2反应的化学方程式为Fe2O3+ SO2+2H+=2Fe2++ SO42-+ H2O,该反应是经历以下两步反应实现的。写出ⅱ的离子方程式:_____________。
ⅰ:Fe2O3 + 6H+ = 2Fe3++3H2O
ⅱ:……
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_____________(填离子符号)。
(3)写出氧化过程中MnO2与SO2反应的化学方程式:_________________。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是___________________。

(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:___________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将某有机物样品3.0g通入足量的氧气后充分燃烧,在120℃条件下将燃烧后的气体通入足量的浓H2SO4中,浓H2SO4增重1.8g,然后将气体再通入足量的氢氧化钡溶液中,可得到沉淀19.7g(不考虑溶解的沉淀物),此时还有标准状况下的气体2.24L,该气体能用于抢救危重病人。实验测得该有机物蒸气的密度是相同条件下氦气的15倍。求该有机物的分子式和通入氧气的总体积(标准状况)?____________
查看答案和解析>>
科目: 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,工业上由铬铁矿(主要成分为FeO·Cr2O3、SiO2等)制备,制备流程如图所示:
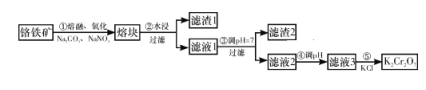
已知:
Ⅰ.步骤①的主要反应为2FeO·Cr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2↑+7NaNO2。
4Na2CrO4+Fe2O3+4CO2↑+7NaNO2。
Ⅱ.2CrO42-+2H+![]() Cr2O72-+H2O。
Cr2O72-+H2O。
下列说法正确的是( )
A. 步骤①熔融、氧化可以在陶瓷容器中进行
B. 步骤①中每生成44.8 L CO2共转移7 mol电子
C. 步骤④若调节滤液2的pH,使之变小,则有利于生成Cr2O72-
D. 步骤⑤生成K2Cr2O7晶体,说明该温度下K2Cr2O7的溶解度大于Na2Cr2O7
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于烃类物质的叙述正确的是( )
A.炔烃CH3—C≡C—CH2—CH3分子中所有的碳原子共直线
B.苯的同系物随着分子中碳原子数目的增加,碳元素的百分含量逐渐减小
C.所有的烯烃两两之间互为同系物
D.正戊烷分子中的碳链是直线型
查看答案和解析>>
科目: 来源: 题型:
【题目】下列分离提纯混合物的方法错误的是( )
A.选用裂化汽油作萃取剂从溴水中萃取溴单质
B.用重结晶法从硝酸钾和氯化钠的混合溶液中获得硝酸钾
C.分离甲苯(沸点为110.6℃)和四氯化碳(沸点为76.75℃)的混合物用蒸馏法
D.通过饱和食盐水除去混在氯气中的少量氯化氢气体
查看答案和解析>>
科目: 来源: 题型:
【题目】夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌、鼓瑟齐鸣。璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应。鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色。请回答下列问题:

(1)火焰利用了部分金属元素特征的__________反应,该反应属于__________(填“物理”或“化学”)变化。
(2)如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含的电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为 ,C可作光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,两元素的原子序数之比为2:1。根据以上信息回答下列问题:
,C可作光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,两元素的原子序数之比为2:1。根据以上信息回答下列问题:
①B的水溶液呈弱酸性,其主要的电离方程式可表示为___________________,D的化学式是___________________。
②A、B、E中均含有的一种元素为___________________(填元素名称)。
③E的电子式为___________________。
④液态B与液态E反应可生成一种气态单质和一种常见液体,1mol B参加反应放出热量Q kJ,其反应的热化学方程式为___________________。
⑤![]() 分子中的N原子有一对孤对电子,能发生反应:
分子中的N原子有一对孤对电子,能发生反应:![]() 。试写出E与足量盐酸发生反应的化学方程式:______________________________________。
。试写出E与足量盐酸发生反应的化学方程式:______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物有许多用途。回答下列问题:
(1)基态![]() 原子的电子排布式为________,锰的第三电离能比铁的第三电离能大,这是因为________________________________________________________。
原子的电子排布式为________,锰的第三电离能比铁的第三电离能大,这是因为________________________________________________________。
(2)![]() 的沸点(71℃)比
的沸点(71℃)比![]() 的沸点(25.7℃)高,主要原因是______________________。
的沸点(25.7℃)高,主要原因是______________________。
(3)根据价层电子对互斥理论,![]() 、
、![]() 、
、![]() 三种微粒中,中心原子价层电子对数不同于其他微粒的是_______。
三种微粒中,中心原子价层电子对数不同于其他微粒的是_______。
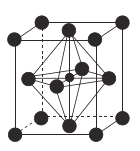
(4)![]() (氮化锰)的晶胞结构如图所示,晶胞参数为0.3851nm。该氮化锰的密度为
(氮化锰)的晶胞结构如图所示,晶胞参数为0.3851nm。该氮化锰的密度为![]() (列出计算式)。________________________________________________________
(列出计算式)。________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:X(g)+2Y(g)![]() 3Z(g) H=﹣a kJ·molˉ1(a>0)。下列说法不正确的是( )
3Z(g) H=﹣a kJ·molˉ1(a>0)。下列说法不正确的是( )
A. 0.1 mol X和0.2 mol Y充分反应生成Z,放出能量一定小于0.1 a kJ
B. Y的起始浓度不能为零,平衡浓度也不能为零
C. 在其他条件不变的情况下,降低反应温度,正、逆反应速率均减小,平衡会发生移动
D. 当反应达到平衡状态时,一定存在3v(Y)正=2v(Z)逆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com