
【题目】将某有机物样品3.0g通入足量的氧气后充分燃烧,在120℃条件下将燃烧后的气体通入足量的浓H2SO4中,浓H2SO4增重1.8g,然后将气体再通入足量的氢氧化钡溶液中,可得到沉淀19.7g(不考虑溶解的沉淀物),此时还有标准状况下的气体2.24L,该气体能用于抢救危重病人。实验测得该有机物蒸气的密度是相同条件下氦气的15倍。求该有机物的分子式和通入氧气的总体积(标准状况)?____________
【答案】4.48L
【解析】
实验测得同体积的该有机物蒸气与氦气的质量之比为15,可知该有机物的相对分子质量为15×4=60;3.0g有机物燃烧,燃烧后的气体通入足量的浓H2SO4中,浓H2SO4增重1.8g为水的质量;然后将气体再通入足量的氢氧化钡溶液中,可得到沉淀19.7g为BaCO3;结合碳元素和氢元素的质量之和判断是否存在氧元素,最后根据有机物的结构简式判断耗氧量;最后还剩余标准状况下的气体2.24L,该剩余气体可用于抢救危重病人,故剩余的气体为氧气,据此分析计算。
实验测得同体积的该有机物蒸气与氦气的质量之比为15,可知该有机物的相对分子质量为15×4=60;
3.0g有机物燃烧,燃烧后的气体通入足量的浓H2SO4中,浓H2SO4增重1.8g为水的质量,则水的物质的量n=![]() =0.1mol,0.1mol水中含有的0.2mol氢原子全部来自于此有机物,即3.0g有机物中含有的氢原子的物质的量为0.2mol,质量m=nM=0.2mol×1g/mol=0.2g;
=0.1mol,0.1mol水中含有的0.2mol氢原子全部来自于此有机物,即3.0g有机物中含有的氢原子的物质的量为0.2mol,质量m=nM=0.2mol×1g/mol=0.2g;
然后将气体再通入足量的氢氧化钡溶液中,可知得到沉淀19.7g为BaCO3,n(BaCO3)=![]() =0.1mol,生成0.1molBaCO3沉淀需要的0.1molCO2中含0.1molC原子全部来自于此有机物,则3.0g有机物中的碳原子的物质的量为0.1mol,质量m=nM=0.1mol×12g/mol=1.2g;
=0.1mol,生成0.1molBaCO3沉淀需要的0.1molCO2中含0.1molC原子全部来自于此有机物,则3.0g有机物中的碳原子的物质的量为0.1mol,质量m=nM=0.1mol×12g/mol=1.2g;
由于(0.2g+1.2g)<3.0g,故有机物中还含氧原子,且含有的氧原子的质量m=3.0g-0.2g-1.2g=1.6g,氧原子的物质的量n=![]() =0.1mol;
=0.1mol;
故此有机物中C、H、O原子个数之比为为0.1∶0.2∶0.1=1∶2∶1,即此有机物的最简式为CH2O,设有机物的分子式为(CH2O)n,根据其相对分子质量为60,可知有:30n=60,即可解得n=2,即有机物分子式为C2H4O2;
3.0gC2H4O2的物质的量n=![]() =0.05mol,设燃烧时的耗氧量为Xmol,根据C2H4O2~2O2可知X=0.1mol,则消耗掉的氧气在标况下的体积V=nVm=0.1mol×22.4L/mol=2.24L,由于最后还剩余标准状况下的气体2.24L,该剩余气体可用于抢救危重病人,故剩余的气体也为氧气,故通入的氧气的总体积V总=2.24L+2.24L=4.48L,故答案为:4.48L。
=0.05mol,设燃烧时的耗氧量为Xmol,根据C2H4O2~2O2可知X=0.1mol,则消耗掉的氧气在标况下的体积V=nVm=0.1mol×22.4L/mol=2.24L,由于最后还剩余标准状况下的气体2.24L,该剩余气体可用于抢救危重病人,故剩余的气体也为氧气,故通入的氧气的总体积V总=2.24L+2.24L=4.48L,故答案为:4.48L。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去):
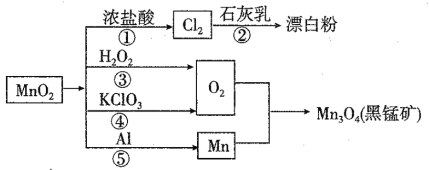
A. 反应①②③④⑤均属于氧化还原反应和离子反应
B. 反应⑤说明该条件下铝的氧化性强于锰
C. 生成等量的O2,反应③和④转移的电子数之比为1:2
D. 反应①中氧化剂与还原剂的物质的量之比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院化学所研制的晶体材料——纳米四氧化三铁,在核磁共振造影及医药上有广泛用途,其生产过程的部分流程如下所示:
FeCl3·6H2O![]() FeOOH
FeOOH![]() 纳米四氧化三铁
纳米四氧化三铁
下列有关叙述不合理的是( )
A.纳米四氧化三铁具有磁性,可作为药物载体用于治疗疾病
B.纳米四氧化三铁可分散在水中,它与FeCl3溶液的分散质直径大小相等
C.在反应①中环丙胺的作用可能是促进氯化铁水解
D.反应②的化学方程式是6FeOOH+CO===2Fe3O4+3H2O+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:
NH3+CO2+H2O=NH4HCO3①
NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl②
将所得碳酸氢钠晶体加热分解后即可得到纯碱。请回答:
(1)工业所制纯碱中常含有少量的氯化钠杂质,其原因___________________________;
(2)现有甲、乙、丙三个小组的学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下。
甲组:取10.00g样品,利用下图所示装置,测出反应后装置C中碱石灰的增重为3.52g。
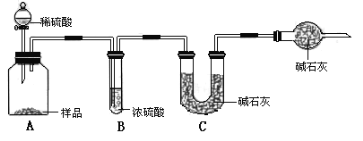
乙组:取10.00g样品,配成1000mL溶液,用碱式滴定管量取25.00mL放入锥形瓶中,加入甲基橙作指示剂,用0.150mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+2HCl=2CaCl2+H2O+CO2↑)。完成三次实验后,消耗盐酸体积的平均值为30.00mL。
丙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量。反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。
请分析、计算后填表:
分析与 计算 分组 | 计算样品中碳酸钠 的质量分数 | 对实验结果 的评价 | 实验失败的主要原因 及对结果的影响 |
甲组 | _______________ | 失败 | ____________ |
乙组 | ____________ | 成功 | |
丙组 | ______________ | 成功 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物有许多用途。回答下列问题:
(1)基态![]() 原子的电子排布式为________,锰的第三电离能比铁的第三电离能大,这是因为________________________________________________________。
原子的电子排布式为________,锰的第三电离能比铁的第三电离能大,这是因为________________________________________________________。
(2)![]() 的沸点(71℃)比
的沸点(71℃)比![]() 的沸点(25.7℃)高,主要原因是______________________。
的沸点(25.7℃)高,主要原因是______________________。
(3)根据价层电子对互斥理论,![]() 、
、![]() 、
、![]() 三种微粒中,中心原子价层电子对数不同于其他微粒的是_______。
三种微粒中,中心原子价层电子对数不同于其他微粒的是_______。
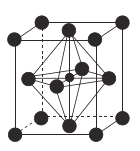
(4)![]() (氮化锰)的晶胞结构如图所示,晶胞参数为0.3851nm。该氮化锰的密度为
(氮化锰)的晶胞结构如图所示,晶胞参数为0.3851nm。该氮化锰的密度为![]() (列出计算式)。________________________________________________________
(列出计算式)。________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如图所示(部分产物已略去):
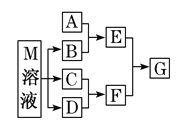
(1)写出B的电子式________。
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,写出A和B水溶液反应的离子方程式________。
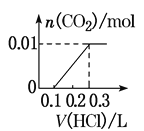
(3)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,生成的CO2物质的量与所用盐酸体积如图所示,则A与B溶液反应后溶液中溶质的化学式_____。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是__________。
(5)若A是一种氮肥, A和B反应可生成气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式为_________。
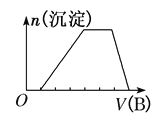
(6)若A是一种溶液,可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32- 、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子的物质的量浓度之比为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓度均为2mol/LAgNO3与Cu(NO3)2溶液各0.5L混合,以铜电极进行电解,一段时间后,阴极上有1.6g铜析出。
(1)直流电源已输出__mol电子。
(2)溶液中c(Cu2+)为_mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是用实验室制得的乙烯(C2H5OH![]() CH2=CH2↑+H2O)与溴水作用制取1,2﹣二溴乙烷的部分装置图,根据图示判断下列说法正确的是
CH2=CH2↑+H2O)与溴水作用制取1,2﹣二溴乙烷的部分装置图,根据图示判断下列说法正确的是

A. 装置①和装置③中都盛有水,其作用相同
B. 装置②和装置④中都盛有NaOH溶液,其吸收的杂质相同
C. 产物可用分液的方法进行分离,1,2﹣二溴乙烷应从分液漏斗的上口倒出
D. 制备乙烯和生成1,2﹣二溴乙烷的反应类型分别是消去反应和加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二铟(In2O3)是一种透明的导电材料,可运用于接触屏、液晶显示器等高科技领域;铟产业被称为“信息时代的朝阳产业”。利用水铟矿[主要成分In(OH)3,常温下Ksp[In(OH)3]=l.41×10-33]制备In2O3的工艺流程如下:
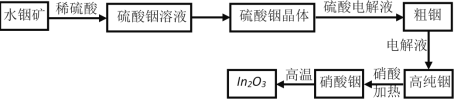
(1)写出水铟矿被硫酸酸浸的离子方程式___________________。
(2)从硫酸铟溶液中制备硫酸铟晶体的实验步骤:____、_____、过滤、洗涤、干燥。
(3)某研究机构用硫酸提取铟时,酸度(每升溶液中含硫酸的质量)与浸出率关系如图
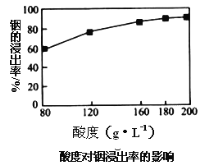
①当酸度为196时,硫酸物质的量浓度为___________。
②请选择适宜的酸度值:_______,并说明选择的理由______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com