
【题目】某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如图所示(部分产物已略去):
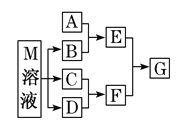
(1)写出B的电子式________。
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,写出A和B水溶液反应的离子方程式________。
(3)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,生成的CO2物质的量与所用盐酸体积如图所示,则A与B溶液反应后溶液中溶质的化学式_____。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是__________。
(5)若A是一种氮肥, A和B反应可生成气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式为_________。
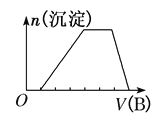
(6)若A是一种溶液,可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32- 、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子的物质的量浓度之比为______________。
【答案】![]() SiO2+2OH-====SiO32-+H2O NaHCO3、Na2CO3 先有白色沉淀生成,随后沉淀逐渐减少最终消失 3Cl2+8NH3===N2+6NH4Cl c(H+)∶c(Al3+)∶c(NH4+)∶c(SO42-)=1∶1∶2∶3
SiO2+2OH-====SiO32-+H2O NaHCO3、Na2CO3 先有白色沉淀生成,随后沉淀逐渐减少最终消失 3Cl2+8NH3===N2+6NH4Cl c(H+)∶c(Al3+)∶c(NH4+)∶c(SO42-)=1∶1∶2∶3
【解析】
由题给信息可知,C可在D中燃烧发出苍白色火焰,则该反应为氢气与氯气反应生成HCl,故C为H2、D为Cl2、F为HCl,M是日常生活中不可缺少的调味品,由题给转化关系可知,M的溶液电解生成氢气、氯气与B,则M为NaCl、B为NaOH。
(1)B为NaOH,氢氧化钠是由钠离子和氢氧根离子组成的离子化合物,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,E为Na2SiO3,二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,反应的离子方程式为SiO2+2OH-=SiO32-+H2O,故答案为:SiO2+2OH-=SiO32-+H2O;
(3)若A是CO2气体,CO2与NaOH溶液能够反应生成碳酸钠或碳酸氢钠或两者的混合物,也有可能氢氧化钠过量,反应后所得的溶液再与盐酸反应,溶液中溶质只有碳酸钠,则碳酸钠转化为碳酸氢钠消耗盐酸体积与碳酸氢钠反应生成二氧化碳消耗盐酸体积相等,由图可知消耗盐酸体积之比为1:2,则CO2与NaOH溶液反应后溶液中溶质为Na2CO3和NaHCO3,故答案为:Na2CO3和NaHCO3;
(4)若A是一种常见金属单质,且与NaOH溶液能够反应,则A为Al,E为NaAlO2,则将过量的HCl溶液逐滴加入NaAlO2溶液中,先生成氢氧化铝,而后氢氧化铝溶解,故看到的现象为溶液中先有白色絮状沉淀生成,且不断地增加,随后沉淀逐渐溶解最终消失,故答案为:先有白色沉淀生成,随后沉淀逐渐减少最终消失;
(5)若A是一种化肥,实验室可用A和NaOH反应制取气体E,E与F相遇均冒白烟,则E为NH3、A为铵盐,E与氯气相遇均冒白烟,且利用E与氯气的反应检验输送氯气的管道是否泄露,则E与D的反应为氨气与氯气反应生成氯化铵和氮气,反应方程式为:3Cl2+8NH3=N2+6NH4Cl,故答案为:3Cl2+8NH3=N2+6NH4Cl;
(6)由图可知,开始加入NaOH没有沉淀和气体产生,则一定有H+,一定没有CO32-,后来有沉淀产生且最后消失,则一定没有Mg2+、Fe3+,一定含有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3H2O的反应,则含有NH4+,由电荷守恒可知一定含有SO42-,发生反应H++OH-=H2O,氢离子消耗NaOH溶液的体积与Al3++3OH-=Al(OH)3↓铝离子消耗NaOH溶液的体积之比为1:3,发生反应NH4++OH-=NH3H2O,铵根消耗氢氧化钠为2体积,则n(H+):n(Al3+):n(NH4+)=1:1:2,由电荷守恒可知,n(H+):n(Al3+):n(NH4+):n(SO42-)=1:1:2:3,故c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3,故答案为:c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3。


科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
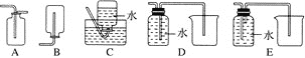
(4)以下收集NO气体的装置,合理的是________(填序号)。
(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的离子积常数Kw与温度T(℃)的关系如图D3-5所示:
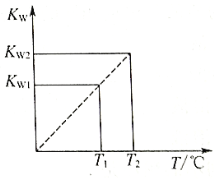
(1)若T1=25℃,则Kw1=_____________;若T2=100℃时,Kw2=10-12,则此时0.05mol/L的Ba(OH)2溶液的pH=_____________。
(2)已知25℃时,0.1L 0.1mol/L的NaA溶液的pH=10,则NaA溶液中存在的平衡有_______________________________________________。
溶液中各离子的物质的量浓度由大到小的顺序为__________________________。
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液的pH=9,则NaOH溶液与硫酸溶液的体积比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓HCl在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中错误的是( )

A.只有①和②处B.只有②处C.只有②和③处D.只有②③④处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要维度。下图为硫及其部分化合物的“价类二维图”, 根据图示回答下列问题:
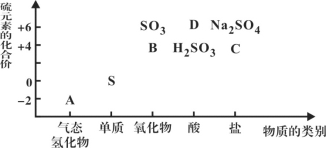
(1)图中A、B、C、D四种物质中,属于非电解质的是__________(用化学式表示)。
(2)足量B通入紫色石蕊试液的现象是______________________________________;
FeCl3溶液(酸性)中通入B的离子方程式为___________________________。
(3)C在反应中既可作氧化剂,又可作还原剂。当它作氧化剂时,理论上其可被还原为____(填标号)。
A.Na2S B.S C.H2SO3 D.Na2SO4 E.H2SO4
(4)从硫元素化合价分析,硫单质具有氧化性和还原性。请举一例说明其具有氧化性(用化学方程式表示)_______________________________。
(5)将A与SO2混合,可生成淡黄色固体。该反应的氧化产物与还原产物的质量之比为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是
A.实验室取用金属钠,所需的用品至少有4种
B.如果3.9gNa2O2固体中含有m个阴离子,则阿伏加德罗常数的值为20m
C.所有金属及其化合物灼烧时火焰均有颜色,焰色反应均应透过蓝色钴玻璃观察
D.K和KH均易与水反应产生H2,K2O2和KO2均易与水反应产生O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的化工原料,以乙烯为原料在不同条件下可合成下列物质(部分条件未标出):

按下列要求写出:
(1)聚乙烯的结构简式是_____________,乙醛的结构简式是_____________;
(2)反应①的化学方程式是________________________________,反应类型是___________;
(3)反应③的化学方程式是________________________________,反应类型是___________;
(4)反应⑤的化学方程式是________________________________,反应类型是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中 使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀。
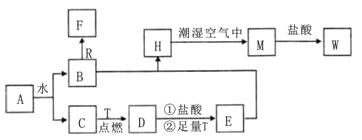
(1)物质A的化学式为 ________,F化学式为 ________;
(2)B和R在溶液中反应生成F的离子方程式为__________________________;
(3)H在潮湿空气中变成M的实验现象是________,化学方程式为______________;
(4)A和水反应生成B和C的化学方程式为__________________________
(5)印刷行业刻制印刷电路板(含有铜箔)时,要用W溶液中作为“腐蚀液”,写出该反应的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com