
【题目】水的离子积常数Kw与温度T(℃)的关系如图D3-5所示:
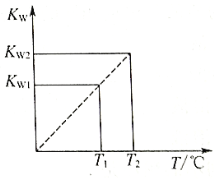
(1)若T1=25℃,则Kw1=_____________;若T2=100℃时,Kw2=10-12,则此时0.05mol/L的Ba(OH)2溶液的pH=_____________。
(2)已知25℃时,0.1L 0.1mol/L的NaA溶液的pH=10,则NaA溶液中存在的平衡有_______________________________________________。
溶液中各离子的物质的量浓度由大到小的顺序为__________________________。
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液的pH=9,则NaOH溶液与硫酸溶液的体积比为_____________。
【答案】![]() 11
11 ![]()
![]() ,
,![]() 1:9
1:9
【解析】
(1) KW只与温度有关,根据图像可知 KW1< KW2, 所以T1< T2,根据KW= c(OH-)![]() c(H+)进行计算;
c(H+)进行计算;
(2)0.1mol/L的NaA溶液pH>7,说明HA为弱酸,溶液中存在的平衡有H2O![]() H++OH- 、 A-+H2O
H++OH- 、 A-+H2O![]() HA+OH-;据此进行分析;
HA+OH-;据此进行分析;
(3)根据酸碱中和,碱过量进行计算:c(OH-)= [c(OH-)×V1- c(H+)×V2]/(V1+V2)进行计算;
(1)25℃时,c(H+)=c(OH-)=10-7mol/L,KW1=10-11;若T2=100℃时,Kw2=10-12,c(OH-)=0.05×2=0.10mol/L,c(H+)=10-12/0.1=10-11, pH=11;综上所述,本题答案是:1×10-11,11。
(2)0.1mol/L的NaA溶液pH>7,说明HA为弱酸,溶液中存在的平衡有H2O![]() H++OH- 、 A-+H2O
H++OH- 、 A-+H2O![]() HA+OH-;离子浓度的大小顺序为c(Na+)> c(A-)> c(OH-)>c(H+);综上所述,本题答案是:H2O
HA+OH-;离子浓度的大小顺序为c(Na+)> c(A-)> c(OH-)>c(H+);综上所述,本题答案是:H2O![]() H++OH- 、A-+H2O
H++OH- 、A-+H2O![]() HA+OH-;c(Na+)> c(A-)> c(OH-)>c(H+)。
HA+OH-;c(Na+)> c(A-)> c(OH-)>c(H+)。
(3)V(NaOH)=xmL,V(H2SO4)=ymL,则有c(OH-)=(10-3x-10-4y)/(x+y)=10-5,解得x:y=1:9。综上所述,本题答案是:1:9。


科目:高中化学 来源: 题型:
【题目】下列物质中既能与稀H2SO4反应,又能与NaOH溶液反应的是( )
①Al ②Fe2O3 ③Na2CO3 ④Al(OH)3 ⑤NaHCO3
A.①②④B.②③⑤C.②④⑤D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的电子式____________,结构简式____________。
(2)鉴别甲烷和乙烯的试剂是______(填序号)。
A.稀硫酸 B.溴的四氯化碳溶液
C.水 D.酸性高锰酸钾溶液
(3)下列物质中,可以通过乙烯加成反应得到的是______(填序号)。
A.CH3CH3 B.CH3CHCl2
C.CH3CH2OH D.CH3CH2Br
(4)已知 2CH3CHO+O2![]() 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
![]()
反应②的化学方程式为____________________________________。 工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2011·惠州市调研)一定温度下,难溶电解质AmBn在水中溶解平衡的溶度积为Ksp=cm(An+)×cn(Bm-)。25℃,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,先出现黄色沉淀,最终生成黑色沉淀。已知有关物质的颜色和溶度积如下:
物质 | AgCl | AgI | Ag2S |
颜色 | 白 | 黄 | 黑 |
Ksp(25℃) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
下列叙述不正确的是( )
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生
C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
D.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列3种有机化合物A:CH2=CH2、B:![]() 、C:CH3COOH。
、C:CH3COOH。
(1)写出化合物A、C中官能团的名称:___________、_______。
(2)3种化合物中能使溴的四氯化碳溶液褪色的是______(写名称),该反应的化学方程式为____。该物质在农业上用作水果的________。
(3)B的名称是_______,它的分子具有______(填分子构型)结构,是否存在单双键交替结构?___(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院化学所研制的晶体材料——纳米四氧化三铁,在核磁共振造影及医药上有广泛用途,其生产过程的部分流程如下:
![]()
下列有关叙述不合理的是
A. 纳米四氧化三铁可分散在水中,它与FeCl3溶液的分散质直径相当
B. 纳米四氧化三铁具有磁性,可作为药物载体用于治疗疾病
C. 在反应①中环丙胺的作用可能是促进氯化铁水解
D. 反应②的化学方程式是6FeOOH +CO=2Fe3O4+3H2O+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:

(1)写出下列物质的官能团名称:B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。

①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A.Na2O2 B.KClC.Na2CO3 D.MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_______________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如图所示(部分产物已略去):
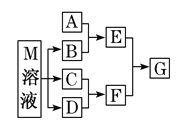
(1)写出B的电子式________。
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,写出A和B水溶液反应的离子方程式________。
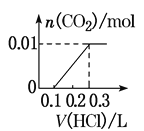
(3)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,生成的CO2物质的量与所用盐酸体积如图所示,则A与B溶液反应后溶液中溶质的化学式_____。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是__________。
(5)若A是一种氮肥, A和B反应可生成气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式为_________。
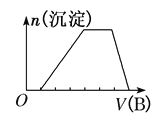
(6)若A是一种溶液,可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32- 、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子的物质的量浓度之比为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列过程中没有发生化学变化的是( )
A. 用活性炭去除冰箱里的异味
B. 用明矾溶液清除铜镜表面的铜锈
C. 用一定比例的生石灰、硫黄和水共煮制石硫合剂农药(棕红色)
D. 古代用银针检验食品中是否含有剧毒粗砒霜(含硫化物杂质的As2O3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com