
【题目】下列物质中既能与稀H2SO4反应,又能与NaOH溶液反应的是( )
①Al ②Fe2O3 ③Na2CO3 ④Al(OH)3 ⑤NaHCO3
A.①②④B.②③⑤C.②④⑤D.①④⑤
科目:高中化学 来源: 题型:
【题目】化合物A能使溴水褪色,E能与NaHCO3反应,且标准状况下1molE与足量Na反应能产生11.2L气体。A的一系列反应如下(部分反应条件及产物略去):
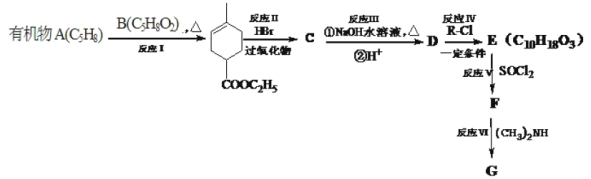
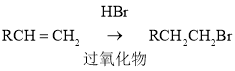
已知:
(1)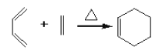
(2)
(3)![]()
回答下列问题:
(1)写出化合物E的结构简式________
(2)下列说法不正确的是________。
A. 有机物B中官能团的是碳碳双键和酯基 B. 有机物C的分子式为C10H17O2Br
C. 反应Ⅲ、Ⅳ、Ⅴ、Ⅵ均属于取代反应 D. 1mol有机物D最多可消耗2molNaOH
(3)写出F→G反应的化学方程式________。
(4)写出C5H9NO2满足下列条件的所有链状同分异构体的结构简式__________。
①红外光谱检测表明分子中含有醛基;②1H-NMR谱显示分子中有3种氢原子。
(5)![]() 是化工生产中的重要原料,请设计以有机物A为原料合成
是化工生产中的重要原料,请设计以有机物A为原料合成![]() 的合成路线________(用流程图表示,无机试剂任选)。
的合成路线________(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.重铬酸钾(K2Cr2O7)是一种强氧化剂,在实验室和工业中都有很广泛的应用。同时,由于其具有致癌作用,也是环境污染物之一,必须进行处理。工业上通常以铬铁矿(主要成分为FeO·Cr2O3,另外还含有SiO2、Al2O3等杂质)为原料制备重铬酸钾,主要流程如下图所示:

已知:①NaFeO2遇水强烈水解,生成红褐色物质;
②2CrO42- (黄色)+2H+![]() Cr2O72- (橙色)+H2O。
Cr2O72- (橙色)+H2O。
请回答下列问题:
(1)滤液1的溶质除Na2CrO4、Na2SiO3外,还含有________________(填化学式);
(2)由滤液2转化为Na2Cr2O7溶液过程中,能说明反应达平衡状态的是________(填字母代号);
a.溶液的颜色不变
b.v(CrO![]() )=2v(Cr2O
)=2v(Cr2O![]() )
)
c.Cr2O![]() 和CrO
和CrO![]() 的浓度相同
的浓度相同
(3)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是加热浓缩、______________、过滤、洗涤、干燥。
Ⅱ.工业废水中常含有一定量的Cr2O![]() 和CrO
和CrO![]() ,常用还原沉淀法处理。该方法的工艺流程为:
,常用还原沉淀法处理。该方法的工艺流程为:
CrO![]()
![]() Cr2O
Cr2O![]()
![]() Cr3+
Cr3+![]() Cr(OH)3
Cr(OH)3
(4)请写出Cr2O![]() 与FeSO4溶液在酸性条件下反应的离子方程式:______________________。
与FeSO4溶液在酸性条件下反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
A. 3.0g甲醛和乙酸的混合物中所含的原子数为![]()
B. ![]() 与
与![]() 充分反应,转移的电子数为
充分反应,转移的电子数为![]()
C. ![]() 的稀硫酸中含有的氢离子数目为
的稀硫酸中含有的氢离子数目为![]()
D. 4.6g有机物![]() 的分子结构中碳氢键数目一定为
的分子结构中碳氢键数目一定为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁均为中学化学常见的物质,它们之间的转化关系如图(反应条件及其它产物已略去).下列说法不正确的是( )
![]()
A. 若甲是AlCl3溶液,则丁可能是NaOH溶液
B. 若甲是Fe,则丁可能是Cl2
C. 若丁是CO2,则甲可能为Mg
D. 若丁是O2,则乙、丙的相对分子质量可能相差16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据不完全统计,全世界每年约有10%~20%的农副产品,水产品会因腐败变质而无法食用,经济损失巨大,所以研究安全无害的食品防腐剂很重要,山梨酸及其盐,尼泊金酯等可作为食品防腐剂,其结构简式如图:
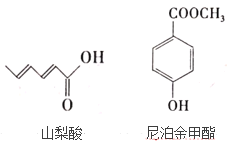
按要求回答下列问题:
(1)写出山梨酸中含氧官能团的名称___。
(2)常温下,等物质的量的山梨酸、尼泊金甲酯分别与足量溴水反应,消耗Br2的物质的量之比为___。
(3)写出尼泊金甲酯与NaOH溶液反应的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z为元素周期表中原子序数依次增大的三种短周期元素,Y与X、Z均相邻,X、Y与Z三种元素原子的最外层电子数之和为19;W的单质为生活中一种常见的金属,在Z元素的单质中燃烧产生棕黄色的烟,生成![]() 。回答下列问题:
。回答下列问题:
(1)Z元素在元素周期表中的第____周期。
(2)![]() 与足量的
与足量的![]() 的水溶液发生反应生成两种强酸,写出该反应的离子方程式____。
的水溶液发生反应生成两种强酸,写出该反应的离子方程式____。
(3)![]() 易升华,易溶于水,乙醇/丙酮等溶剂。据此推测其晶体熔化时克服的作用力是__,判断的依据是____。
易升华,易溶于水,乙醇/丙酮等溶剂。据此推测其晶体熔化时克服的作用力是__,判断的依据是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
(4)以下收集NO气体的装置,合理的是________(填序号)。
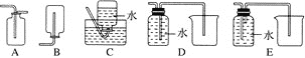
(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的离子积常数Kw与温度T(℃)的关系如图D3-5所示:
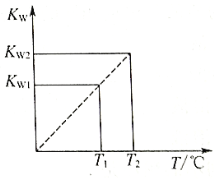
(1)若T1=25℃,则Kw1=_____________;若T2=100℃时,Kw2=10-12,则此时0.05mol/L的Ba(OH)2溶液的pH=_____________。
(2)已知25℃时,0.1L 0.1mol/L的NaA溶液的pH=10,则NaA溶液中存在的平衡有_______________________________________________。
溶液中各离子的物质的量浓度由大到小的顺序为__________________________。
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液的pH=9,则NaOH溶液与硫酸溶液的体积比为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com