
【题目】化合物A能使溴水褪色,E能与NaHCO3反应,且标准状况下1molE与足量Na反应能产生11.2L气体。A的一系列反应如下(部分反应条件及产物略去):
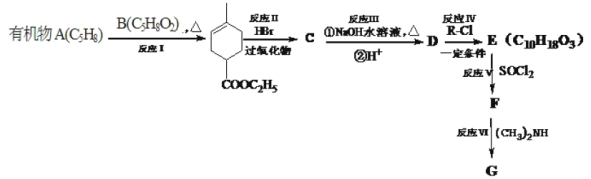
已知:
(1)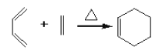
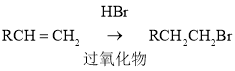
(2)
(3)![]()
回答下列问题:
(1)写出化合物E的结构简式________
(2)下列说法不正确的是________。
A. 有机物B中官能团的是碳碳双键和酯基 B. 有机物C的分子式为C10H17O2Br
C. 反应Ⅲ、Ⅳ、Ⅴ、Ⅵ均属于取代反应 D. 1mol有机物D最多可消耗2molNaOH
(3)写出F→G反应的化学方程式________。
(4)写出C5H9NO2满足下列条件的所有链状同分异构体的结构简式__________。
①红外光谱检测表明分子中含有醛基;②1H-NMR谱显示分子中有3种氢原子。
(5)![]() 是化工生产中的重要原料,请设计以有机物A为原料合成
是化工生产中的重要原料,请设计以有机物A为原料合成![]() 的合成路线________(用流程图表示,无机试剂任选)。
的合成路线________(用流程图表示,无机试剂任选)。
【答案】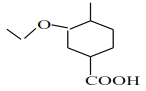 D
D 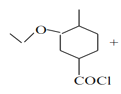 (CH3)2NH→
(CH3)2NH→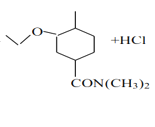
![]()
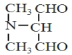
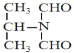
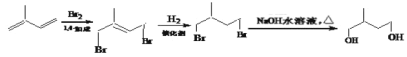
【解析】
根据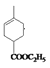 可推出A为二烯烃,且应为2-甲基-1,3-丁二烯,即
可推出A为二烯烃,且应为2-甲基-1,3-丁二烯,即![]() ,根据B的分子式及(1)
,根据B的分子式及(1) 可推知B为CH2=CHCOOC2H5,根据已知(2)
可推知B为CH2=CHCOOC2H5,根据已知(2)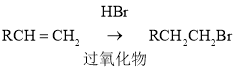 ,
, 与HBr在过氧化物作用下反应生成
与HBr在过氧化物作用下反应生成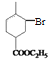 ,
, 在氢氧化钠的水溶液中加热发生水解反应再酸化生成D为
在氢氧化钠的水溶液中加热发生水解反应再酸化生成D为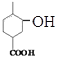 ,E能与NaHCO3反应,且标准状况下1molE与足量Na反应能产生11.2L气体,结合反应可知,D与乙醇发生取代反应生成E,E为
,E能与NaHCO3反应,且标准状况下1molE与足量Na反应能产生11.2L气体,结合反应可知,D与乙醇发生取代反应生成E,E为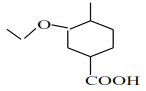 ,根据已知(3)
,根据已知(3)![]() 可推出F为
可推出F为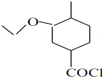 ,G为
,G为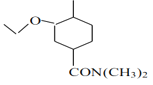 ,据此分析。
,据此分析。
(1)化合物E的结构简式为 ;
;
(2)A. 有机物B为CH2=CHCOOC2H5,官能团的是碳碳双键和酯基,选项A正确;
B. 有机物C为 ,分子式为C10H17O2Br,选项B正确;
,分子式为C10H17O2Br,选项B正确;
C.根据上述分析及各物质的结构简式可知,反应Ⅲ、Ⅳ、Ⅴ、Ⅵ均属于取代反应,选项C正确;
D. D为 ,含有醇羟基和羧基,1mol有机物D最多可消耗1molNaOH,选项D不正确;
,含有醇羟基和羧基,1mol有机物D最多可消耗1molNaOH,选项D不正确;
答案选D;
(3)F→G反应的化学方程式为 +(CH3)2NH→
+(CH3)2NH→ +HCl;
+HCl;
(4)C5H9NO2①红外光谱检测表明分子中含有醛基;②1H-NMR谱显示分子中有3种氢原子,则分子高度对称,满足条件的链状同分异构体的结构简式有![]() 、
、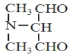 、
、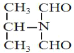 ;
;
(5)![]() 是化工生产中的重要原料,
是化工生产中的重要原料,![]() 与溴发生1,4-加成得到
与溴发生1,4-加成得到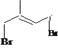 ,
, 在催化剂作用下与氢气发生加成反应生成
在催化剂作用下与氢气发生加成反应生成![]() ,
,![]() 在氢氧化钠的水溶液中加热发生水解反应生成
在氢氧化钠的水溶液中加热发生水解反应生成![]() ,故以有机物A(
,故以有机物A(![]() )为原料合成
)为原料合成![]() 的合成路线如下
的合成路线如下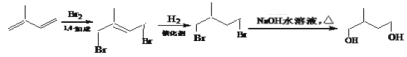 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图表示A、B、C、D、E五种含氮物质相互转化的关系。其中A、B、C、D常温下都是气体,B为红棕色。
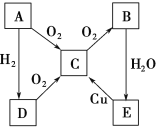
(1)写出下列物质的名称:
B________; E________。
(2)写出各步反应的化学方程式:
①A→C________________________________________;
②D→C________________________________________;
③C→B_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学的知识填空。
(1)已知铜在常温下能被稀HNO3溶解:3Cu + 8HNO3=3Cu(NO3)2 + 2NO↑+ 4H2O
①用双线桥法表示上述电子转移的方向和数目(在化学方程式上标出)______。
②请将上述反应改写成离子方程式:_________________________________________;
③19.2g铜与稀硝酸完全反应,生成的气体在标准状况下的体积为_________________L;若4 mol HNO3参加反应,则该过程转移电子的数目为__________________________。
(2)标准状况下,44.8 L由O2和CO2组成的混合气体的质量为82g,则O2的质量为_________g,该混合气体的平均摩尔质量为_______________________。
(3)3.4g NH3中所含氢原子数目与标准状况下__________ L CH4所含氢原子数相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式表达,正确的是
A.碳酸氢钠溶于水的电离方程式:NaHCO3![]() Na++H++CO32-
Na++H++CO32-
B.氯气与水反应:Cl2 + H2O![]() 2H+ + Cl- + ClO-
2H+ + Cl- + ClO-
C.氢氧化钡溶液与稀硫酸混合:Ba2++ OH- + SO42- + H+ = BaSO4↓ + H2O
D.向FeI2溶液中通入少量的氯气:2I-+Cl2 = 2Cl-+I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮物质等被广泛应用于化工、轻工、化肥、制药、合成纤维、塑料等行业中,是最重要的化工产品之一。
(一)发射卫星时可用N2H4为燃料,若用氟作氧化剂,已知:
![]()
![]()
![]()
![]()
![]()
![]()
则N2H4与F2反应的热化学方程式为:________。
(二)汽车尾气净化反应:![]() △H
△H
(1)该反应的逆反应速率随时间变化的关系如图:
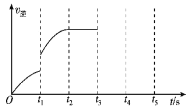
反应在t2时达平衡,在t1时改变了某种条件,改变的条件不可能是________。
A. 升温 B. 加压
C. 使用催化剂 D. 增大NO的浓度
(2)某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率及CO2的体积分数变化图如下:
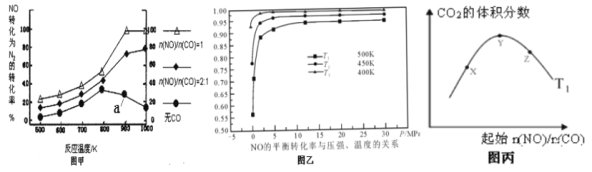
下列说法正确的是________。
A. 由图乙可得△H<0,反应低温自发
B. 为达到NO转化为N2的最佳转化率,应该选择的温度为900K,n(NO)/n(CO)=1
C. 图甲中对应的a点一定处于平衡状态
D. 图丙中X、Y、Z三点,CO的转化率由大到小的关系为Z>Y>X
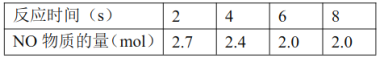
(3)向初始体积为4.5L的密闭容器中通入3molNO、1.5molCO,在恒压条件下发生反应:![]() ,平衡体系中NO的物质的量变化见下表。此温度下,该反应的平衡常数K=________。
,平衡体系中NO的物质的量变化见下表。此温度下,该反应的平衡常数K=________。
(三)尿素被广泛用作氮肥。
(1)在恒容的密闭容器中,发生反应![]() 。测得H2O的平衡转化率随温度的变化关系如图所示,已知T4时达平衡所需时间为t。请在图中画出反应经相同时间t时,H2O的转化率随温度变化的曲线。______________
。测得H2O的平衡转化率随温度的变化关系如图所示,已知T4时达平衡所需时间为t。请在图中画出反应经相同时间t时,H2O的转化率随温度变化的曲线。______________
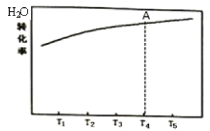
(2)工业上可通过电解的方法处理尿素![]() 的碱性溶液,产物中无污染物,试写出电解时阳极的电极反应式________。
的碱性溶液,产物中无污染物,试写出电解时阳极的电极反应式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组需要480 mL 0.1000 mol/L的NaOH溶液。欲在实验室用固体烧碱配制。请回答下列问题:

(1)本实验需用托盘天平称量烧碱的质量为_____g。
(2)配制过程中,不需要的仪器(填写代号)________________。
a.烧杯 b.冷凝管 c.玻璃棒 d.1000mL容量瓶 e.漏斗 f.胶头滴管
(3)根据实验需要和(2)所列仪器判断,完成实验还缺少的仪器有药匙、___、___。
(4)请说出本实验中玻璃棒的作用____________。
(5)将上图中的实验步骤A~F按实验过程先后次序排列______________。
(6)请用恰当的文字描述上图A操作的过程____________________________。
(7)若配制过程中,其他操作都准确,下列操作能引起浓度偏高的有______(填代号)。
①用来溶解NaOH的烧杯里面有少许水
②未等稀释后的NaOH溶液冷却至室温就转移到容量瓶中
③将NaOH溶液转移到容量瓶时,不小心撒到了外面少许
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述不正确的是( )
A.石油液化气、汽油和石蜡的主要成分都是碳氢化合物
B.1,2-二氯乙烷在NaOH醇溶液中发生消去反应可以得到乙炔
C.由CH2=CHCOOCH3合成的聚合物为![]()
D.能与NaOH溶液反应且分子式为C2H4O2的有机物一定是羧酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中溴元素以Br﹣形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图:

请回答下列问题.
(1)将海水浓缩的方法是__;
(2)步骤①反应的离子方程式是__,1molCl2参加反应,转移电子__mol;
(3)步骤②通入热空气吹出Br2,利用了Br2的__(填序号);
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(4)步骤③中用SO2的水溶液吸收Br2,吸收率可达95%,该反应的氧化剂是__,在工业生产中此步骤应解决的问题是__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既能与稀H2SO4反应,又能与NaOH溶液反应的是( )
①Al ②Fe2O3 ③Na2CO3 ④Al(OH)3 ⑤NaHCO3
A.①②④B.②③⑤C.②④⑤D.①④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com