
����Ŀ��������ѧ��֪ʶ��ա�
(1)��֪ͭ�ڳ������ܱ�ϡHNO3�ܽ⣺3Cu + 8HNO3=3Cu(NO3)2 + 2NO��+ 4H2O
����˫���ŷ���ʾ��������ת�Ƶķ������Ŀ(�ڻ�ѧ����ʽ�ϱ��)______��
���뽫������Ӧ��д�����ӷ���ʽ��_________________________________________��
��19.2gͭ��ϡ������ȫ��Ӧ�����ɵ������ڱ�״���µ����Ϊ_________________L����4 mol HNO3�μӷ�Ӧ����ù���ת�Ƶ��ӵ���ĿΪ__________________________��
(2)��״���£�44.8 L��O2��CO2��ɵĻ�����������Ϊ82g����O2������Ϊ_________g���û�������ƽ��Ħ������Ϊ_______________________��
(3)3.4g NH3��������ԭ����Ŀ���״����__________ L CH4������ԭ������ͬ��
���𰸡� 3Cu+8H++2NO3-=3Cu2++2NO��+4H2O 4.48 3NA��1.806��1024 16 41g/mol 3.36
3Cu+8H++2NO3-=3Cu2++2NO��+4H2O 4.48 3NA��1.806��1024 16 41g/mol 3.36
��������
��1��Cu+4HNO3�TCu��NO3��2+2NO2��+2H2O�У�CuԪ�صĻ��ϼ��� 0����Ϊ+2�ۣ�NԪ�صĻ��ϼ���+5�۽���Ϊ+4�ۣ��÷�Ӧ��ת��2mol���ӣ�������������Ԫ�صĻ��ϼ۵ı仯�ж�����������ԭ�����Լ��μ�������ԭ��Ӧ����������ʵ�����
��2������n=![]() ����CO��CO2��ɵĻ����������ʵ�������CO��CO2�����ʵ����ֱ�Ϊxmol��ymol�����ݶ������ʵ������������з��̼���x��y��ֵ����������CO��CO2�����ʵ���֮�ȣ�����M=
����CO��CO2��ɵĻ����������ʵ�������CO��CO2�����ʵ����ֱ�Ϊxmol��ymol�����ݶ������ʵ������������з��̼���x��y��ֵ����������CO��CO2�����ʵ���֮�ȣ�����M=![]() �����������ƽ��Ħ��������
�����������ƽ��Ħ��������
��3������n=![]() ��������������ʵ������ٸ���N=nNA��������а��������������е���ԭ����Ŀ����ϼ���ķ��ӽṹ�����������ʵ���������V=nVm�����������
��������������ʵ������ٸ���N=nNA��������а��������������е���ԭ����Ŀ����ϼ���ķ��ӽṹ�����������ʵ���������V=nVm�����������
��1���ٻ��ϼ�����Ԫ��Cuʧ���ӣ����ϼ۽���Ԫ��N�õ����ӣ����ϼ�������=���ϼ۽�����=ת�Ƶ�����=6������ת��������£� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
����3Cu+8HNO3�T3Cu��NO3��2+2NO��+4H2O��Ӧ�У�HNO3��Cu��NO3��2����ˮ�ҵ��룬Ӧд�����ӵ��γɣ���д������ӷ���ʽΪ3Cu+8H++2NO3-�T3Cu2++2NO��+4H2O���ʴ�Ϊ��3Cu+8H++2NO3-�T3Cu2++2NO��+4H2O��
��ͭ�����ʵ���Ϊ0.3mol���÷�Ӧ��CuԪ����0�����ߵ�+2�ۣ���0.3mol Cuʧȥ�ĵ���Ϊ0.3mol����2-0��=0.6mol����NO�����ʵ���Ϊn���ɵ����غ��֪��0.3mol��2=n����5-2�������n=0.2mol����NO�����Ϊ4.48L���ɷ���ʽ3Cu+8HNO3�T3Cu��NO3��2+2NO��+4H2O��֪8 mol����μӷ�Ӧ��ת��6mol���ӣ������4mol����μӷ�Ӧ��ת�Ƶ���3mol������Ϊ3NA��1.806��1024���ʴ�Ϊ��4.48��3NA��1.806��1024��
��2�������44.8 L��O2��CO2��ɵĻ����������ʵ���Ϊ![]() =2mol����O2��CO2�����ʵ����ֱ�Ϊxmol��ymol����x+y=2mol��32x+44y=82g��
=2mol����O2��CO2�����ʵ����ֱ�Ϊxmol��ymol����x+y=2mol��32x+44y=82g��
��ã�x=0.5��y=1.5����������O2�ĵ���Ϊ0.5mol��32g/mol=16g����������ƽ��Ħ������Ϊ��![]() =41g/mol���ʴ�Ϊ��16��41g/mol��
=41g/mol���ʴ�Ϊ��16��41g/mol��
��3����������Է���������17����Ħ��������17g/mol����3.4g���������ʵ���Ϊ��n��NH3��=![]() =0.2mol��������ԭ�ӵ���ĿΪ��N��H��=3N��NH3��=0.6NA���백������Hԭ����Ŀ��ȵ�CH4�����ʵ���
=0.2mol��������ԭ�ӵ���ĿΪ��N��H��=3N��NH3��=0.6NA���백������Hԭ����Ŀ��ȵ�CH4�����ʵ���![]() =0.15NA����CH4�����=0.15mol��22.4L/mol=3.36L���ʴ�Ϊ�� 3.36��
=0.15NA����CH4�����=0.15mol��22.4L/mol=3.36L���ʴ�Ϊ�� 3.36��


 ������ϵ�д�
������ϵ�д� �±�Сѧ��Ԫ�Բ���ϵ�д�
�±�Сѧ��Ԫ�Բ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A����Ȼ������Ҫ�ɷ֣���AΪԭ����һ�������¿ɻ���л���B��C��D��E��F�����ת����ϵ��ͼ����֪��B�ڱ�״���µ��ܶ�Ϊ1.16g��L��1��C�ܷ���������Ӧ��FΪ��Ũ����ζ����������ˮ����״Һ�塣
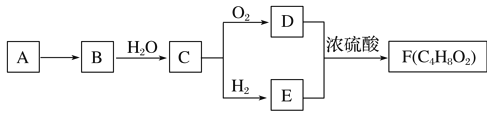
��ش�
��1���л���D�к��еĹ�����������___��
��2��D+E��F�ķ�Ӧ������___��
��3���л���A�ڸ�����ת��ΪB�Ļ�ѧ����ʽ��___��
��4������˵����ȷ����___��
��A���л���E������Ʒ�Ӧ��ˮ������Ʒ�ӦҪ����
��B���л���D��E��F���ñ���Na2CO3��Һ����
��C��ʵ�����Ʊ�Fʱ��Ũ������Ҫ����������
��D���л���C�ܱ����Ƽ���������ͭ����Һ������KMnO4��Һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ�����ӷ���ʽ��д��ȷ���ǣ� ��
A.����������Һ�����ķ�Ӧ��OH����H+��H2O
B.�����Ķ�����̼���������Ʒ�Ӧ��![]() ��
��
C.��Ƭ����������Һ��Ӧ��3Fe+2Al3+��2Al + 3Fe2��
D.��������Һ�м�������������Һ��Ba2++SO42-��BaSO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�����Ʊ�����ˮ�ij��÷�����

��1����ͼ��ʵ������ȡ����ˮ�ij���װ�ã�ͼ�����Ե�һ��������__________________________��
��2������A��������____________________������B��������____________________________��
��3��ʵ��ʱA�г�������������ˮ�⣬������뼸��______________ ���������Ƿ�ֹҺ�屩�С�
��4������ƿȡ�����ռ�����Һ�����Թ��У�Ȼ�����___________________�� _______________�����Լ��Ļ�ѧʽ���������Ƿ����Cl����
��5����ͼװ��Ҳ��������������ˮ����ȡ�����ȼ��̶������ԣ�����ԭ������ͼ��ȫ��ͬ����װ����ʹ�õIJ������ܽϳ�����������______________________________��Ϊ���������Ч�����ձ������ʢ�е������� ___________�������ƣ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������װ�ÿ����Ʊ���ˮ�Ȼ����������й�˵����ȷ����(����)
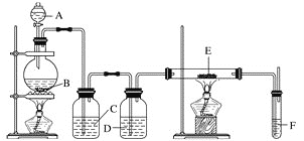
A. ��ƿB���Ʊ������ķ�Ӧ��ΪMnO2��ϡ����
B. װ��C��D�зֱ�ʢ��Ũ���ᡢ����ʳ��ˮ
C. װ��E��װ��F֮����Ҫ����һ������װ�ã������Ƶ���ˮ�Ȼ���
D. װ��F��Ŀ���Ǽ������������ݳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ԭ�ӵ�������ag,12Cԭ�ӵ�������bg����NAֻ��ʾ�����ӵ���������ֵ��������˵������ȷ����( )
�ٸ���ԭ�ӵ����ԭ������Ϊ![]() ��mg����ԭ�ӵ����ʵ���Ϊ
��mg����ԭ�ӵ����ʵ���Ϊ![]() mol
mol
�۸���ԭ�ӵ�Ħ��������aNA g ��ag����ԭ�������ĵ�����Ϊ16NA
A. �٢� B. �ڢ� C. �٢� D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�����ʵ�����HI��g������2L�ĺ����ܱ������У�ֻ������Ӧ2HI(g) ![]() H2(g)+I2(g) ��H��������������ͬʱ����Ӧ��HI��g�������ʵ���n��mol���淴Ӧʱ�䣨min���ı仯������±���
H2(g)+I2(g) ��H��������������ͬʱ����Ӧ��HI��g�������ʵ���n��mol���淴Ӧʱ�䣨min���ı仯������±���

���ݱ������ݣ�����˵����ȷ����
A.��ʵ��1�У���Ӧ��10��20����ʱ����v(HI)=1.3��10-2mol/(Lmin)
B.��ʵ��2�У���20minʱ��Ӧǡ�ôﵽƽ��״̬
C.����ʵ��2��ʵ��3����˵��Ũ��Խ��Ӧ����Խ��
D.����ʵ��2��ʵ��4�����жϷ�Ӧ��H��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������A��ʹ��ˮ��ɫ��������NaHCO3��Ӧ���ұ�״����1molE������Na��Ӧ�ܲ���11.2L���塣A��һϵ�з�Ӧ���£����ַ�Ӧ������������ȥ����
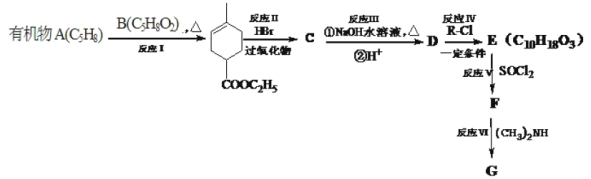
��֪��
��1��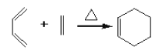
��2��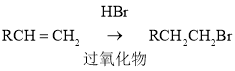
��3��![]()
�ش��������⣺
��1��д��������E�Ľṹ��ʽ________
��2������˵������ȷ����________��
A. �л���B�й����ŵ���̼̼˫�������� B. �л���C�ķ���ʽΪC10H17O2Br
C. ��Ӧ����������������ȡ����Ӧ D. 1mol�л���D��������2molNaOH
��3��д��F��G��Ӧ�Ļ�ѧ����ʽ________��
��4��д��C5H9NO2��������������������״ͬ���칹��Ľṹ��ʽ__________��
�ٺ���������������к���ȩ������1H-NMR����ʾ��������3����ԭ�ӡ�
��5��![]() �ǻ��������е���Ҫԭ�ϣ���������л���AΪԭ�Ϻϳ�
�ǻ��������е���Ҫԭ�ϣ���������л���AΪԭ�Ϻϳ�![]() �ĺϳ�·��________��������ͼ��ʾ�����Լ���ѡ����
�ĺϳ�·��________��������ͼ��ʾ�����Լ���ѡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.�ظ����(K2Cr2O7)��һ��ǿ����������ʵ���Һ�ҵ�ж��кܹ㷺��Ӧ�á�ͬʱ������������°�������Ҳ�ǻ�����Ⱦ��֮һ��������д�������ҵ��ͨ���Ը�����(��Ҫ�ɷ�ΪFeO��Cr2O3���������SiO2��Al2O3������)Ϊԭ���Ʊ��ظ��������Ҫ��������ͼ��ʾ��

��֪����NaFeO2��ˮǿ��ˮ�������ɺ��ɫ���ʣ�
��2CrO42- (��ɫ)��2H��![]() Cr2O72- (��ɫ)��H2O��
Cr2O72- (��ɫ)��H2O��
��ش��������⣺
(1)��Һ1�����ʳ�Na2CrO4��Na2SiO3����������________________(�ѧʽ)��
(2)����Һ2ת��ΪNa2Cr2O7��Һ����������˵����Ӧ��ƽ��״̬����________(����ĸ����)��
a����Һ����ɫ����
b��v(CrO![]() )��2v(Cr2O
)��2v(Cr2O![]() )
)
c��Cr2O![]() ��CrO
��CrO![]() ��Ũ����ͬ
��Ũ����ͬ
(3)��Na2Cr2O7��Һ�м���KCl���������K2Cr2O7����IJ��������Ǽ���Ũ����______________�����ˡ�ϴ�ӡ����
��.��ҵ��ˮ�г�����һ������Cr2O![]() ��CrO
��CrO![]() �����û�ԭ�������������÷����Ĺ�������Ϊ��
�����û�ԭ�������������÷����Ĺ�������Ϊ��
CrO![]()
![]() Cr2O
Cr2O![]()
![]() Cr3��
Cr3��![]() Cr(OH)3
Cr(OH)3
(4)��д��Cr2O![]() ��FeSO4��Һ�����������·�Ӧ�����ӷ���ʽ��______________________��
��FeSO4��Һ�����������·�Ӧ�����ӷ���ʽ��______________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com