
����Ŀ�����ʵ����ͺ���Ԫ�صĻ��ϼ����о��������ʵ�������Ҫά�ȡ���ͼΪ���䲿�ֻ�������������άͼ���� ����ͼʾ�ش��������⣺
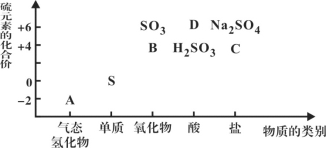
(1)ͼ��A��B��C��D���������У����ڷǵ���ʵ���__________(�û�ѧʽ��ʾ)��
(2)����Bͨ����ɫʯ����Һ��������______________________________________��
FeCl3��Һ(����)��ͨ��B�����ӷ���ʽΪ___________________________��
(3)C�ڷ�Ӧ�мȿ������������ֿ�����ԭ����������������ʱ����������ɱ���ԭΪ____(����)��
A��Na2S B��S C��H2SO3 D��Na2SO4 E��H2SO4
(4)����Ԫ�ػ��ϼ۷��������ʾ��������Ժͻ�ԭ�ԡ����һ��˵�������������(�û�ѧ����ʽ��ʾ)_______________________________��
(5)��A��SO2��ϣ������ɵ���ɫ���塣�÷�Ӧ�����������뻹ԭ���������֮��Ϊ__________________________��
���𰸡�SO2 ʯ����Һ��ɺ�ɫ 2Fe3++SO2+2H2O=2Fe2++SO42��+4H+ AB Fe+S![]() FeS��H2+S
FeS��H2+S![]() H2S 2��1
H2S 2��1
��������
����ͼ���ļ�̬�����ʵĶ�Ӧ��ϵ������ȷ������A��B��C��D�������ʷֱ�ΪH2S��SO2��Na2SO3��H2SO4��
��1��ͼ��A��B��C��D���������У����ڷǵ���ʵ���SO2�����ڵ���ʵ���H2S��Na2SO3��H2SO4��ͨ���ǽ������������ڷǵ���ʣ��ᡢ������ڵ���ʣ�
��2��SO2ͨ����ɫʯ����Һ�����Ƿ�Ӧ����H2SO3��SO2+H2O![]() H2SO3������������H+ʹʯ���Ժ�ɫ��FeCl3������Һ��ͨ��SO2ʱ������Ӧ�����ӷ���ʽ��2Fe3++SO2+2H2O=2Fe2++SO42-+4H+��
H2SO3������������H+ʹʯ���Ժ�ɫ��FeCl3������Һ��ͨ��SO2ʱ������Ӧ�����ӷ���ʽ��2Fe3++SO2+2H2O=2Fe2++SO42-+4H+��
��3��CΪNa2SO3������SΪ+4�ۣ�����������������ԭʱ����Ļ��ϼ۽����ͣ���������ֻ��Na2S��S�е���Ԫ�ػ��ϼ۵���+4�ۣ���ѡA���B�
��4����Ԫ�ػ��ϼ۷�������������Ϊ0�ۣ������м��̬���Ⱦ��������Ժͻ�ԭ�ԡ���������������ʱ��ͨ�����ϼ۽�Ϊ-2�ۣ����統�������������Ϊ������Ӧʱ��Fe+S![]() FeS����������Ӧʱ��H2+S
FeS����������Ӧʱ��H2+S![]() H2S��
H2S��
��5��H2S��SO2�������巢����Ӧ��2H2S+SO2=3S+2H2O������������ͻ�ԭ�����ΪS�����л�ԭ����ÿ����1mol��������������2mol���������������뻹ԭ��������ʵ���֮��Ϊ2��1����������Ҳ��2��1��


 �ľ�ͼ���ʱ�ȷ�ϵ�д�
�ľ�ͼ���ʱ�ȷ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������ϩ������������ȥ�����е���ϩ���ʵķ�����
A. ͨ��������NaOH��ҺB. ͨ����������ˮ
C. ��Ni��������������ͨ��H2D. ͨ������������KMnO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֽ�����ɵĺϽ�50g , ������������Ӧ������ȥ����71 g , ��úϽ���ܵ�����ǣ� ��
A. п��ͭ B. �ƺ�ͭ C. �ƺ��� D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵��ȷ����(����)
A. �����£�0.2 mol Fe������ˮ������Ӧ�����ɵ�H2������ĿΪ0.3NA
B. ��1molCl����NH4Cl��Һ�м���������ˮʹ��Һ�����ԣ���ʱ��Һ��NH4+��ΪNA
C. ��CO2ͨ��Na2O2ʹ������������mg����Ӧ��ת�Ƶĵ�����mNA/14
D. 17.6 g�����������ļ��Թ��ۼ�Ϊ6.4 NA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ʊ�����Fe3O4�Ĺ�����ͼ��ʾ�������й��������������� (����)
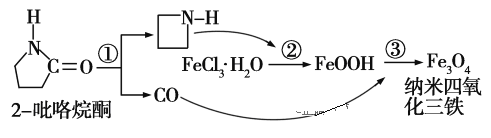
A. ��Ӧ���ķ�Ӧ����Ϊ��ȥ��Ӧ
B. ����Fe3O4��ɢ���ʵ��ܼ��У���ǿ������ʱ����������������
C. ��Ӧ���У������������ÿ����Ǵٽ��Ȼ���ˮ��
D. ��Ӧ���Ļ�ѧ����ʽΪ��6FeOOH��CO===2Fe3O4��3H2O��CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ�У���ȷ����
A. ��FeCl3��Һ��ʴͭ��·�壺Cu + 2Fe3+��Cu2+ + 2Fe2+
B. ��������ˮ:Cl2+H2O=2H++Cl-+ClO-
C. ����������Һ��ϡH2SO4��Ӧ��Ba2++SO42-=BaSO4��
D. ̼������Һ����μ������������2H+ + CO32����CO2��+ H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�������ճ�����������Ӧ�ù㷺���о������仯�����Ӧ�������ش�
(1)������Ԫ��ֻ�л�ԭ�Ե�������_________��
A��Fe B��FeCl2 C��FeCl3 D��Fe2O3
(2)������ȱ��ʱ��������Ҫ�Բ�������Ʒ�������ܹ����յ���+2�۵���������+2�۵��������ױ�������
����μ���ij���岹��������Ԫ���ѱ�������д���������̡������ۡ�
��____________________________________________________________________��
�ڷ���ά����C����ʹʳ���е�����������ת��Ϊ���������ӡ��ɴ˿���֪��ά����C����________________(�ѧ����)��
(3) �������(K2FeO4)��һ�����͡���Ч�������ɫˮ��������ʪ���Ʊ��������(K2FeO4)�ķ�Ӧ��ϵ������������Fe(OH)3��C1O-��OH-��FeO42-��Cl-��H2O��д������ƽʪ���Ƹ�����ص����ӷ�Ӧ����ʽ��_____Fe(OH)3+_____ClO-+_________=_____FeO42-+_____Cl-+_________
(4)��ҵ�����Ȼ�����ʴͭ���������·�塣ij����ʦΪ�˴�ʹ�ù��ĸ�ʴ��Һ�л���ͭ��������Ȼ������壬���������в��裺
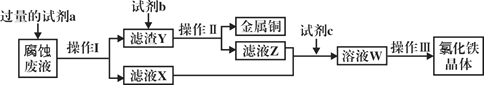
�ش���������:
���Լ�a��___________������I�õ��IJ����������ձ�����������___________��
����ҺX��Z�ж���ͬһ�����ʣ�����ת��Ϊ��ҺW�����ӷ���ʽΪ___________��
�����������в���III����________________��________________�����ˡ�ϴ�ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڱ�ϩ���ӣ�CH3��CH=CH2����˵����ȷ����
A. �� 7 �� �� ����1 �� �� ��B. ����ʽΪ CH2
C. ����� 7 ��ԭ�ӹ�ƽ��D. 3 ��̼ԭ����ͬһֱ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������(Na2S2O3)���н�ǿ�Ļ�ԭ�ԣ���������ǿ�ᷴӦ���ھ�ϸ��������Ӧ�ù㷺����SO2ͨ�밴һ���������Ƴɵ�Na2S��Na2CO3�Ļ����Һ�У����Ƶ�Na2S2O3��5H2O(���մ�)��
(1)ʵ������Na2SO3�������Ʊ�SO2����ѡ�õ����巢��װ����________(����)������װ�������ԵIJ����ǣ��ر�ֹˮ�У���_____________��
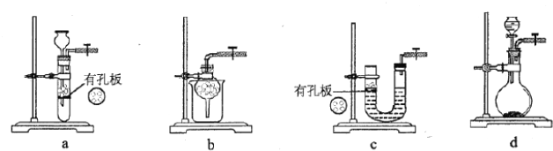
(2)��Na2S��Na2CO3�Ļ����Һ�в���ͨ��SO2����Ĺ����У����֣�
��dz��ɫ�����������࣬��Ӧ�Ļ�ѧ����ʽΪ_________________(���ɵ���Ϊ����)��
��dz��ɫ��������һ��ʱ�䲻�䣬����ɫ��ζ�������������Ӧ�Ļ�ѧ����ʽΪ____________________(���ɵ���Ϊ����)��
��dz��ɫ��������(��ʱ��Na2S2O3����)��
������ͨ��SO2��dz��ɫ�����ֻ������࣬��Ӧ�Ļ�ѧ����ʽΪ____(���ɵ���Ϊ��ʽ��)��
(3)�Ʊ�Na2S2O3ʱ��Ϊ��ʹ��Ӧ�����������Na2S��Na2CO3�����ʵ���֮��ӦΪ____________��ͨ����Ӧ˳�ɱȽϳ����¶���ͬʱ��ͬ���ʵ���Ũ�ȵ�Na2S��Һ��Na2CO3��ҺpH�������_________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com