
【题目】制备纳米Fe3O4的过程如图所示:下列有关叙述不合理的是 ( )
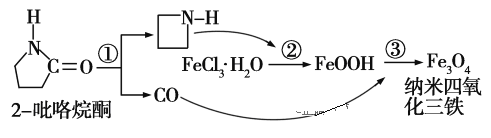
A. 反应①的反应类型为消去反应
B. 纳米Fe3O4分散在适当溶剂中,当强光照射时,会产生丁达尔现象
C. 反应②中,环丙胺的作用可能是促进氯化铁水解
D. 反应③的化学方程式为:6FeOOH+CO===2Fe3O4+3H2O+CO2
【答案】A
【解析】
本题考查了胶体的定义与性质、有机反应类型的判断、盐类的水解等知识。A.反应①不符合消去反应的定义;胶体可产生丁达尔现象;环丙胺溶液呈碱性,可促进Fe3+的水解;根据得失电子守恒和元素守恒。
A.反应①不符合消去反应的定义,所以不属于消去反应,故A项错误;B.纳米Fe3O4分散在适当的溶剂中可形成胶体,胶体可产生丁达尔现象,B项正确;C. Fe3+的水解使溶液显酸性,环丙胺溶液呈碱性,可促进Fe3+的水解,C项正确;D.FeOOH中铁的化合价为+3,而Fe3O4中铁的化合价可看做+![]() ,根据得失电子守恒和元素守恒可写出化学方程式6FeOOH+CO=2Fe3O4+3H2O+CO2,D项正确。所以答案为A。
,根据得失电子守恒和元素守恒可写出化学方程式6FeOOH+CO=2Fe3O4+3H2O+CO2,D项正确。所以答案为A。


科目:高中化学 来源: 题型:
【题目】浓硫酸具有的重要性质有酸性、吸水性,脱水性、强氧化性。请把下列现象中浓硫酸表現出来的性质填写在对应的空白处:
(1)把浓硫酸滴在白纸上,白纸变黑,则浓硫酸表现________;
(2)盛有浓硫酸的烧杯敞口放置一段时间,质最增加,则浓硫酸表现出________;
(3)浓硫酸与碳共热时发生反应2H2SO4(浓)+C![]() CO2↑+ 2SO2↑+2H2O,在该反应中,浓硫酸表现出________。
CO2↑+ 2SO2↑+2H2O,在该反应中,浓硫酸表现出________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列陈述正确并且有因果关系的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | SO2有漂白性 | SO2可使溴水褪色 |
B | Cl2有漂白性 | Cl2能使品红溶液褪色 |
C | 浓硫酸有脱水性 | 浓硫酸可用于干燥H2和CO |
D | Fe3+有强氧化性 | FeCl3溶液可用于回收废旧电路板中的铜 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两种物质作用,反应条件(温度、反应物浓度、用量或滴加顺序等)改变,不会引起产物改变的是( )
A.Na和O2B.Fe与HClC.Cu和HNO3D.Na2CO3和HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3、K2SO4、KAl(SO4)2三种物质组成的混合溶液中,K+的浓度为0.25mol/L,加入等体积0.20mol/L的KOH溶液,使生成的白色沉淀恰好溶解,那么原溶液中SO42-的浓度是( )
A. 0.20mol/L B. 0.25mol/L C. 0.225mol/L D. 0.45mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要维度。下图为硫及其部分化合物的“价类二维图”, 根据图示回答下列问题:
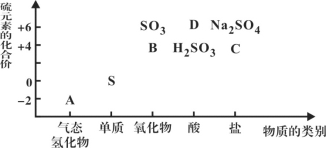
(1)图中A、B、C、D四种物质中,属于非电解质的是__________(用化学式表示)。
(2)足量B通入紫色石蕊试液的现象是______________________________________;
FeCl3溶液(酸性)中通入B的离子方程式为___________________________。
(3)C在反应中既可作氧化剂,又可作还原剂。当它作氧化剂时,理论上其可被还原为____(填标号)。
A.Na2S B.S C.H2SO3 D.Na2SO4 E.H2SO4
(4)从硫元素化合价分析,硫单质具有氧化性和还原性。请举一例说明其具有氧化性(用化学方程式表示)_______________________________。
(5)将A与SO2混合,可生成淡黄色固体。该反应的氧化产物与还原产物的质量之比为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
A. SO3和SiO2B. CO2和H2O
C. NaCl和HClD. CCl4和KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。(已知Co2O3的氧化性>Cl2的氧化性)。从废料中回收氧化钴(CoO)的工艺流程如下:
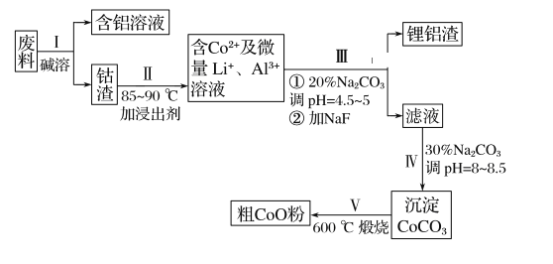
(1)过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为__________。
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出含钴物质的反应化学方程式为(产物中只有一种酸根)__________________________________。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请分析不用盐酸浸出钴的主要原因:___________________________________________________________。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式:__________________________________。
(4)碳酸钠溶液在过程Ⅲ和Ⅳ中所起作用有所不同,请写出在过程Ⅳ中起的作用是_____。
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是________(填标号)。
A.c(Na+)=2c(CO![]() ) B.c(Na+)>c(CO
) B.c(Na+)>c(CO![]() )>c(HCO
)>c(HCO![]() )
)
C.c(OH-)>c(HCO![]() )>c(H+) D.c(OH-)-c(H+)=c(HCO
)>c(H+) D.c(OH-)-c(H+)=c(HCO![]() )+2c(H2CO3)
)+2c(H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com