
【题目】在Al2(SO4)3、K2SO4、KAl(SO4)2三种物质组成的混合溶液中,K+的浓度为0.25mol/L,加入等体积0.20mol/L的KOH溶液,使生成的白色沉淀恰好溶解,那么原溶液中SO42-的浓度是( )
A. 0.20mol/L B. 0.25mol/L C. 0.225mol/L D. 0.45mol/L
【答案】A
【解析】
本题考查溶液中离子浓度的计算问题。解答时根据电荷守恒进行判断,加入等体积的0.20mol/L的KOH溶液,使生成的白色沉淀恰好溶解,能把淀溶液中的铝离子变成偏铝酸根离子,Al3++4OH-=AlO2-+2H2O。溶液呈电中性,根据电荷守恒,则原溶液中3c(Al3+)+c(K+)=2c(SO42-)。
加入等体积的0.20mol/L的KOH溶液,使生成的白色沉淀恰好溶解,能把淀溶液中的铝离子变成偏铝酸根离子,Al3++4OH-=AlO2-+2H2O,则原溶液中铝离子的浓度为0.2/4=0.05mol/L。而溶液呈电中性,即阳离子所带电荷数等于阴离子所带电荷数,则原溶液中3c(Al3+)+c(K+)=2c(SO42-),解得原溶液中钾离子的浓度为0.25mol/L,所以SO42-的浓度为(0.25mol/L+0.05mol/L![]() )/2= 0.20mol/L,故D答案为A。
)/2= 0.20mol/L,故D答案为A。


科目:高中化学 来源: 题型:
【题目】有下列三组液体:①75%的乙醇溶液;②氯化钠溶液和四氯化碳组成的混合液;③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏B.蒸馏、分液、结晶
C.分液、结晶、萃取D.蒸馏、分液、萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法正确的是
A. 1g氢气含有NA个H2分子
B. 1mol铁与过量稀盐酸反应生成NA个H2分子
C. 14g由N2与CO组成的混合气体含有的原子数目为0.5 NA
D. 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量CO2通入2L某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示。下列有关叙述正确的是
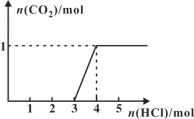
A. 通入的CO2气体体积为22.4 L
B. 原溶液中c(NaOH)=1 mol/L
C. A溶液中含Na2CO3和NaHCO3 各1mol
D. A溶液中含有2molNaOH和1mol Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)所含铁元素只有还原性的物质是_________。
A.Fe B.FeCl2 C.FeCl3 D.Fe2O3
(2)当人体缺铁时,往往需要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。
①如何检验某固体补铁剂中铁元素已被氧化?写出操作过程、现象及结论。
答:____________________________________________________________________。
②服用维生素C,可使食物中的三价铁离子转化为二价铁离子。由此可推知,维生素C具有________________(填化学性质)。
(3) 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、C1O-、OH-、FeO42-、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:_____Fe(OH)3+_____ClO-+_________=_____FeO42-+_____Cl-+_________
(4)工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:
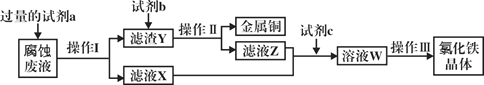
回答下列问题:
①试剂a是___________,操作I用到的玻璃仪器有烧杯、玻璃棒和___________。
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为___________。
③上述流程中操作III包括________________、________________、过滤、洗涤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备纳米Fe3O4的过程如图所示:下列有关叙述不合理的是 ( )
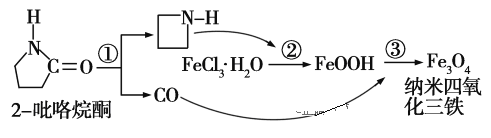
A. 反应①的反应类型为消去反应
B. 纳米Fe3O4分散在适当溶剂中,当强光照射时,会产生丁达尔现象
C. 反应②中,环丙胺的作用可能是促进氯化铁水解
D. 反应③的化学方程式为:6FeOOH+CO===2Fe3O4+3H2O+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法正确的是
A. 1g氢气含有NA个H2分子
B. 1mol铁与过量稀盐酸反应生成NA个H2分子
C. 14g由N2与CO组成的混合气体含有的原子数目为0.5 NA
D. 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】伪麻黄碱(D)是新康泰克的成分之一,能够缓解感冒时带来的鼻塞、流鼻涕和打喷嚏等症状,其中一种合成路线如下:
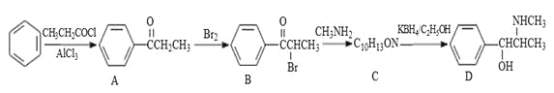
回答下列问题:
(1)伪麻黄碱(D)的分子式为 ;B中含有的官能团有 (写名称)。
(2)写出 B—C反应的化学方程式: 。C—D的反应类型为 。
(3)B的消去产物可以用于合成高分子化合物E,请写出 E的结构简式: 。
(4)满足下列要求的A的同分异构体有 种;
①能发生银镜反应
②苯环上的一氯代物有两种结构,其中核磁共振氢谱为4组峰,且峰面积之比为6:2:1:1的为 (写结构简式)。
(5)已知:![]() 。参照上述合成路线,设计一条由苯和乙酸为起始原料制备
。参照上述合成路线,设计一条由苯和乙酸为起始原料制备![]() 的合成路线: 。
的合成路线: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com