
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。(已知Co2O3的氧化性>Cl2的氧化性)。从废料中回收氧化钴(CoO)的工艺流程如下:
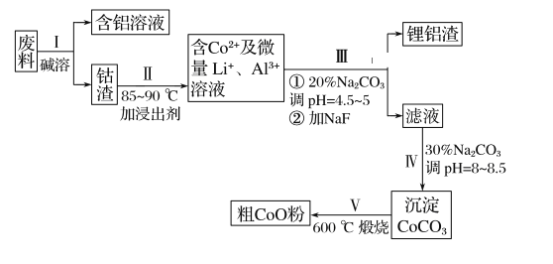
(1)过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为__________。
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出含钴物质的反应化学方程式为(产物中只有一种酸根)__________________________________。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请分析不用盐酸浸出钴的主要原因:___________________________________________________________。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式:__________________________________。
(4)碳酸钠溶液在过程Ⅲ和Ⅳ中所起作用有所不同,请写出在过程Ⅳ中起的作用是_____。
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是________(填标号)。
A.c(Na+)=2c(CO![]() ) B.c(Na+)>c(CO
) B.c(Na+)>c(CO![]() )>c(HCO
)>c(HCO![]() )
)
C.c(OH-)>c(HCO![]() )>c(H+) D.c(OH-)-c(H+)=c(HCO
)>c(H+) D.c(OH-)-c(H+)=c(HCO![]() )+2c(H2CO3)
)+2c(H2CO3)
【答案】2Al+2OH-+2H2O===2AlO2-+3H2↑4Co2O3·CoO+Na2S2O3+11H2SO4===12CoSO4+Na2SO4+11H2OCo2O3·CoO可氧化盐酸产生Cl2,污染环境2Al3++3CO32-+3H2O===2Al(OH)3↓+3CO2↑调节pH,提供CO32-,使Co2+沉淀为CoCO3BCD
【解析】
废料用碱液溶解,过滤得到偏铝酸钠溶液和钴渣;用硫酸溶解钴渣,发生反应:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O,得到含有钴离子的溶液,然后调节溶液pH并用碳酸钠溶液除去杂质铝离子,得到较纯净的含有钴离子的溶液,再加入碳酸钠、调节溶液的pH将钴离子转化成碳酸钴沉淀,最后灼烧碳酸钴得到氧化钴。
(1)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子反应方程式为:2Al+2OH-+2H2O=+2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=+2AlO2-+3H2↑;
(2)Co3O4和Na2S2O3在酸性条件下发生氧化还原反应生成CoSO4、Na2SO4和H2O,反应方程式为:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O;盐酸具有还原性,能被Co2O3CoO氧化生成有毒的氯气而污染环境,所以不能盐酸,故答案为:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O;Co2O3CoO可氧化盐酸产生Cl2,污染环境;
(3)铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;故答案为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;
(4)碳酸钠溶液在过程Ⅲ中铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳;碳酸钠溶液在过程Ⅳ中调整pH,提供CO32-,使Co2+沉淀为CoCO3;故答案为:调整pH,提供CO32-,使Co2+沉淀为CoCO3;
(5)A.由物料守恒可知c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3),故A错误;B.碳酸根离子发生水解,且以第一步水解为主,所以溶液中离子浓度:c(Na+)>c(CO32-)>c(HCO3-),故B正确;C.碳酸根离子发生水解,水解呈碱性,且存在两步水解,则溶液中离子浓度:c(OH-)>c(HCO3-)>c(H+),故C正确;D.Na2CO3溶液中质子守恒:c(OH-)-c(H+)═c(HCO3-)+2c(H2CO3),故D正确;故答案为:BCD。


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】制备纳米Fe3O4的过程如图所示:下列有关叙述不合理的是 ( )
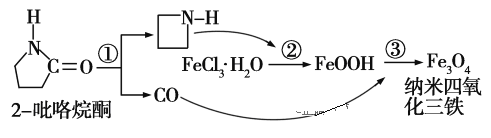
A. 反应①的反应类型为消去反应
B. 纳米Fe3O4分散在适当溶剂中,当强光照射时,会产生丁达尔现象
C. 反应②中,环丙胺的作用可能是促进氯化铁水解
D. 反应③的化学方程式为:6FeOOH+CO===2Fe3O4+3H2O+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 甲烷和Cl2的反应类型与乙烯和Br2的反应类型相同
B. 分子式为C4H7ClO2,可与NaHCO3反应产生CO2的有机物可能有3种结构
C. 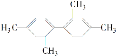 分子中至少有11个碳原子处于同一平面上
分子中至少有11个碳原子处于同一平面上
D. 1mol有机物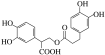 一定条件下能和7molNaOH反应
一定条件下能和7molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳碳单键可以绕键轴自由旋转,结构简式为如下图所示的烃,下列说法中正确的是( )

A. 分子中处于同一直线上的碳原子最多有6个
B. 分子中至少有12个碳原子处于同一平面上
C. 该烃苯环上的一氯代物共有 3种
D. 该烃苯环上一氯代物共有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)具有较强的还原性,还能与中强酸反应,在精细化工领域应用广泛。将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O3·5H2O(大苏打)。
(1)实验室用Na2SO3和硫酸制备SO2,可选用的气体发生装置是________(填标号);检查该装置气密性的操作是:关闭止水夹,再_____________。
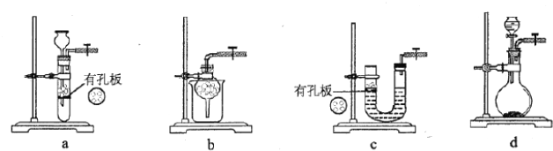
(2)向Na2S和Na2CO3的混合溶液中不断通入SO2气体的过程中,发现:
①浅黄色沉淀先逐渐增多,反应的化学方程式为_________________(生成的盐为正盐);
②浅黄色沉淀保持一段时间不变,有无色无味的气体产生,则反应的化学方程式为____________________(生成的盐为正盐);
③浅黄色沉淀逐渐减少(这时有Na2S2O3生成);
④继续通入SO2,浅黄色沉淀又会逐渐增多,反应的化学方程式为____(生成的盐为酸式盐)。
(3)制备Na2S2O3时,为了使反应物利用率最大化,Na2S和Na2CO3的物质的量之比应为____________;通过反应顺序,可比较出:温度相同时,同物质的量浓度的Na2S溶液和Na2CO3溶液pH更大的是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为测定一定质量的钠与水反应产生的氢气的体积,设计了图装置进行实验。

(1)实验开始,欲使钠与水接触反应,应如何操作?______________________________;反应开始后,试管中能观察到的现象是__________________________________________。
(2)已知有关物质的密度ρ(K):0.86 g·cm-3,ρ(Na):0.97 g·cm-3,ρ(煤油):0.8 g·cm-3。如果将钠换成相同大小的钾进行上述实验,结果钾反应完所用时间比钠反应完所用的时间________(填“长”或“短”),其原因是________________________________。
(3)从实验的安全考虑,比较金属钠、钾与水反应的实验操作图A、图B,请指出图B表示哪种金属与水反应____________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:N2(g)+3H2(g)![]() 2NH3(g)ΔH=﹣92.4 kJ
2NH3(g)ΔH=﹣92.4 kJ![]() ,
,
2H2(g)+O2(g)====2H2O(l)ΔH=﹣571.6 kJ![]() ,
,
则2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) ΔH=_______。
4NH3(g)+3O2(g) ΔH=_______。
(2)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图中信息,回答下列问题:
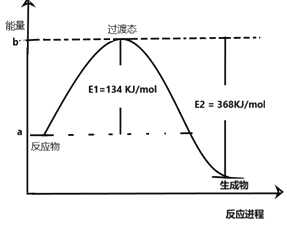
上图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出CO2和NO反应生成NO2和CO的热化学方程式:__________________________________。在反应体系中加入催化剂,E1和E2的变化是:E1__,E2__(填“增大”“减小”或“不变”),对反应热是否有影响?__(填“是”或“否”),原因是________________________________________。
(3)常温常压下断裂1 mol气体分子化学键所吸收的能量或形成1 mol气体分子化学键所放出的能量称为键能(单位为kJ·mol-1)。下表是一些键能数据(kJ·mol-1):请完成下列问题。
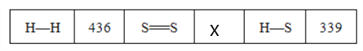
热化学方程式2H2(g)+S2(g)===2H2S(g) ΔH=-229 kJ·mol-1,则X=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com