
【题目】既能用来鉴别甲烷与乙烯,又能用来除去甲烷中的乙烯杂质的方法是
A. 通过足量的NaOH溶液B. 通过足量的溴水
C. 在Ni催化、加热条件下通入H2D. 通过足量的酸性KMnO4溶液
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。

(1)仪器D的名称是 。安装F中导管时,应选用图2中的 。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。
为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜 (填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是 。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为 ,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是 。
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是 ,原因是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸具有的重要性质有酸性、吸水性,脱水性、强氧化性。请把下列现象中浓硫酸表現出来的性质填写在对应的空白处:
(1)把浓硫酸滴在白纸上,白纸变黑,则浓硫酸表现________;
(2)盛有浓硫酸的烧杯敞口放置一段时间,质最增加,则浓硫酸表现出________;
(3)浓硫酸与碳共热时发生反应2H2SO4(浓)+C![]() CO2↑+ 2SO2↑+2H2O,在该反应中,浓硫酸表现出________。
CO2↑+ 2SO2↑+2H2O,在该反应中,浓硫酸表现出________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质对应的用途不正确的是( )
A | B | C | D | |
物质 | Fe2O3 | SO2 | Si | Na2O |
用途 | 作红色涂料 | 防腐剂 | 作半导体材料 | 作供氧剂 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符且正确的是
A. 漂白粉溶液在空气中失效:ClO-+CO2+H2O==HClO+HCO3-
B. 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-==Mn2++Cl2↑+2H2O
C. 向澄清的石灰水中通入过量的CO2:CO2 + OH- == HCO3-
D. 在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要维度。下图为硫及其部分化合物的“价类二维图”, 根据图示回答下列问题:
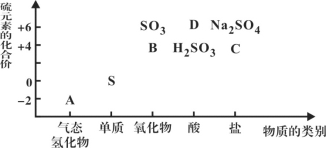
(1)图中A、B、C、D四种物质中,属于非电解质的是__________(用化学式表示)。
(2)足量B通入紫色石蕊试液的现象是______________________________________;
FeCl3溶液(酸性)中通入B的离子方程式为___________________________。
(3)C在反应中既可作氧化剂,又可作还原剂。当它作氧化剂时,理论上其可被还原为____(填标号)。
A.Na2S B.S C.H2SO3 D.Na2SO4 E.H2SO4
(4)从硫元素化合价分析,硫单质具有氧化性和还原性。请举一例说明其具有氧化性(用化学方程式表示)_______________________________。
(5)将A与SO2混合,可生成淡黄色固体。该反应的氧化产物与还原产物的质量之比为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com