
科目: 来源: 题型:
【题目】2017年南京理工大学合成出下图的离子化合物,该物质由两种阳离子和两种阴离子构成,其中有两种10电子离子和一种18电子离子。X、Y、Z、M均为短周期元素,且均不在同一族。下列说法不正确的是
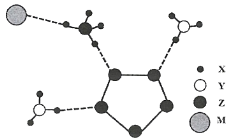
A.X与Y形成的化合物沸点高于Y同族元素与X形成的化合物
B.Z的最高价氧化物对应水化物的酸性比M的强
C.Y气态氢化物的稳定性比Z的强
D.在该盐中,存在极性共价键和非极性共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】对可逆反应2A(s)+3B(g) ![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①②B.④C.③D.④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是探究发生腐蚀的装置图。发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升。下列说法不正确的是

A. 两种腐蚀负极的电极反应式均为Fe-2e-=Fe2+
B. 开始时发生的是析氢腐蚀
C. 一段时间后发生的是吸氧腐蚀
D. 析氢反应的总反应式为2Fe+O2+2H2O=2Fe(OH)2
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组利用如图所示装置探究二氧化硫的性质。已知该实验过程可产生足量的二氧化硫。(装置中固定仪器未画出)
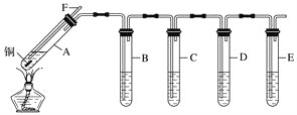
(1)A中所装试剂为铜片和__(填试剂名称),导管F的作用是__。
(2)D中的试剂为0.5mol·L-1BaCl2溶液,实验中无明显现象,若改为同浓度的Ba(NO3)2溶液,则出现白色沉淀,此沉淀的化学式为__,证明SO2具有__性。
(3)装置B用于验证SO2的漂白性,则其中所装溶液为__(填字母)。
A.酸性高锰酸钾溶液 B.品红溶液
C.石蕊溶液 D.蓝色的碘-淀粉溶液
(4)实验时,B中溶液褪色,并有大量气泡冒出,但始终未见C中饱和澄清石灰水出现浑浊或沉淀。请推测可能的原因,并设计实验验证。
可能原因:__。
实验验证:__。
(5)E中Na2S溶液用于验证SO2的氧化性,可观察到的现象为__。
(6)指出上述装置中的不足之处:__。
查看答案和解析>>
科目: 来源: 题型:
【题目】镍钴锰三元材料是近年来开发的一类新型锂离子电池正极材料,具有容量高、循环稳定性好、成本适中等重要优点。镍钴锰三元材料中Ni为主要活泼元素,通常可以表示为:LiNiaCobMncO2,其中a+b+c=1,可简写为LiAO2。充电时总反应为LiAO2 + nC = Li1-xAO2 + LixCn(0<x<1),工作原理如下图所示,则以下说法正确的是( )
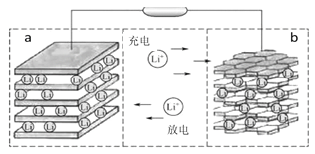
A. 放电时Ni元素最先失去电子
B. 放电时电子从a电极由导线移向b电极
C. 充电时的阳极反应式为LiAO2 - xe-= Li1-xAO2 + xLi+
D. 充电时转移1mol电子,理论上阴极材料质量增加7g
查看答案和解析>>
科目: 来源: 题型:
【题目】十九大报告中提出要“打赢蓝天保卫战”,意味着对污染防治比过去要求更高。某种利用垃圾渗透液实现发电、环保二位一体结合的装置示意图如下,当该装置工作时,下列说法正确的是
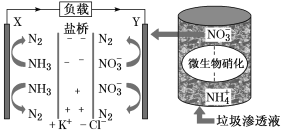
A.盐桥中Cl-向Y极移动
B.电路中流过7.5 mol电子时,共产生标准状况下N2的体积为16.8L
C.电流由X极沿导线流向Y极
D.Y极发生的反应为2NO3-+10e-+6H2O===N2↑+12OH—,周围pH增大
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可用作分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得。实验室模拟该工业过程的装置如图所示。
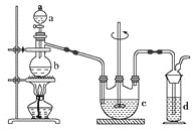
回答下列问题:
(1)a中试剂为__________,b中试剂为__________,c中试剂为____________________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是______________。
(3)d中的试剂为__________________。
(4)实验中要控制SO2生成速率,可以采取的措施有________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】主族元素X、Y、Z、W的原子序数依次增加,且均不大于20,X的单质是手机电池重要的电极材料;常温下,Y的两种气态氧化物之间可发生可逆反应;X、Y、W最外层电子数之和与Z的最外层电子数相等;W能形成多种氧化物。下列说法正确的是
A.常温下,Z的单质与Y的简单氢化物相遇,可能产生白烟
B.Z非金属性强于Y,其对应含氧酸的酸性:Z>Y
C.原子半径:X>Y;简单离子半径:Z<W
D.X、W的单质均为活泼金属,通常保存在煤油中
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加徳罗常数的值,下列说法正确的是
A.常温下,1L pH=13的Ba(OH)2溶液中OH-数目为0.2NA
B.在电解精炼粗铜的过程中,当阴极质量增重32 g时转移电子数目为NA
C.常温常压下,1 mol分子式为C2H6O的有机物中,含有C—O键的数目为NA
D.氢氧燃料电池正极消耗22.4L气体时,负极消耗的气体分子数目为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知32 g甲醇燃烧生成二氧化碳和液态水放出的热量为725. 76 kJ,若上述过程生成的水为气态,则放出的热量________(填“大于”“小于”或“等于”) 725.76kJ。
(2)生产甲醇的原料 CO 和 H2来源于CH4(g)+H2O (g)CO(g)+3H2(g)△H > 0,100℃时,将1 mol CH4和2 mol H2O通入容积为1L的定容密封容器中,发生上述反应。
①能说明该反应已达到平衡状态的是________(填字母代号)。
a.容器内气体密度恒定
b.单位时间内消耗0.1mol CH4的同时生成0.3mol H2
c.容器内的压强恒定
d.3v正(CH4) = v 逆(H2)
②如果反应开始至 5 min 后达到平衡 ,且平衡时CH4 的转化率为 50%,则从开始到平衡这段时间内用比表示的反应速率为___________。
(3)近几年开发的甲醇燃料电池采用作铂电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理示意图如图所示:
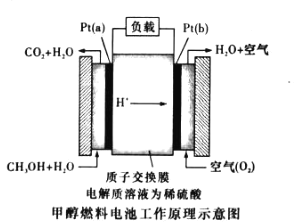
①P t (a)电极是电池的________极,电极反应式为_____________ 。
②如果该电池工作时电路中通过1.806×1023个电子,则消耗 CH3OH___g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com