
科目: 来源: 题型:
【题目】砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)ASH3的电子式为___;AsH3通入AgNO3溶液中可生成Ag, As2 O3和HNO3,该反应中氧化剂与还原剂的物质的量之比为___。
(2)改变O. 1 mol · L-1三元弱酸H3 AsO4溶液的pH,溶液中的H3 AsO4、H2 AsO4-、HAsO42-以及AsO43-的物质的量分布分数随pH的变化如图所示:

①1gKal ( H3 AsO4)=___;用甲基橙作指示剂,用NaOH溶液滴定H3 ASO4发生的主要反应的离子方程式为___
②反应H2 AsO4-+AsO43-=2HAsO42-的lgK=_____
(3)焦炭真空冶炼砷的其中两个热化学反应如下:
As2O3(g)+3C(s)=2As(g)+3CO(g) ![]() H1=akJ/mol
H1=akJ/mol
As2O3(g)+3C(s)=1/2As4(g)+3CO(g) ![]() H2=bkJ/mol
H2=bkJ/mol
则反应4As(g)=As4(g)![]() H=_______kJ/mol(用含a、b的代数式表示)。
H=_______kJ/mol(用含a、b的代数式表示)。
(4)反应2As2S3(s)=4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:

①对应温度下,B点的反应速率v(正) ___v(逆)(填“>’,’’<”或“一”)。
②A点处,AsS(g)的分压为___kPa,该反应的Kp=___kPa5 (Kp为以分压表示的平衡常数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】长期存放的亚硫酸钠可能会被部分氧化,现通过实验来测定某无水亚硫酸钠试剂的纯度。实验步骤如下:
①称量ag样品,置于烧杯中。
②加入适量蒸馏水,使样品溶解。
③加入稀盐酸,使溶液呈强酸性,再加过量的BaCl2溶液。
④过滤,用蒸馏水洗涤沉淀。
⑤加热干燥沉淀物。
⑥将沉淀物冷却至室温后,称量。
⑦重复⑤、⑥操作直到合格,最后得到bg固体。
回答下面问题:
(1)本实验中是否能用Ba(NO3)2代替BaCl2?________;其理由是________。
(2)步骤③中加盐酸使溶液呈强酸性的目的是_____________________。
(3)步骤⑦的“合格”标准是:_____________________。
(4)实验测得样品中无水亚硫酸钠占原有样品的质量分数是_____________________。(列出算式,不需化简)
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)热分解法制氢。某温度,H2O(g) ![]() H2(g)+1/2O2(g)。该反应平衡常数表达式K=_____
H2(g)+1/2O2(g)。该反应平衡常数表达式K=_____
(2)热化学循环制氢。制备H2的反应步骤如下:
①Br2(g) + CaO(s) = CaBr2(s) + 1/2O2(g) ΔH=-73 kJ·mol-1
②3FeBr2(s) + 4H2O(g) = Fe3O4(s) + 6HBr(g) + H2(g) ΔH=+384 kJ·mol-1
③CaBr2(s) + H2O (g) = CaO(s) + 2HBr(g) ΔH=+212 kJ·mol-1
④Fe3O4(s)+8 HBr(g) = Br2(g) + 3FeBr2(s) + 4H2O(g) ΔH=-274 kJ·mol-1
则 H2O(g) ![]() H2(g)+1/2O2(g) ΔH =_________kJ·mol-1。
H2(g)+1/2O2(g) ΔH =_________kJ·mol-1。
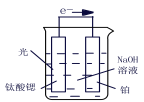
(3)光电化学分解制氢,钛酸锶光电极:4OH--4e- ![]() O2+2H2O,则铂电极的电极反应为_______。
O2+2H2O,则铂电极的电极反应为_______。
(4)水煤气法制氢。CO(g) + H2O(g) ![]() CO2(g)+ H2(g) ΔH <0,在850℃时,K=1。
CO2(g)+ H2(g) ΔH <0,在850℃时,K=1。
① 若升高温度到950℃时,达到平衡时K_________1(填“>”、“<”或 “=”)。
② 850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2 和x mol H2,若要使上述反应开始时向正反应方向进行,则x应满足的条件是_________。
(5)甲烷制氢。将1.0 mol CH4和2.0 mol H2O (g)通入容积为100 L的反应室,在一定条件下发生反应:CH4(g) + H2O (g)=CO (g) + 3H2(g)。测得达到平衡所需的时间为5 min,CH4的平衡转化率为50%,则用H2表示该反应的平均反应速率为_____。
(6)LiBH4具有非常高的储氢能力,分解时生成氢化锂和两种非金属单质。该反应的化学方程式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Ksp(BaSO4)= 1.1×10-10,Ksp(BaCO3)=2.5×10-9。下列说法中不正确的是
A.BaSO4比BaCO3溶解度小,所以,BaCO3可以转化为BaSO4
B.BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂
C.向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42-)/ c(CO32-) =4.4×10-2
D.常温下,BaCO3若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度必须不低于2.2×10-6mol·L-1
查看答案和解析>>
科目: 来源: 题型:
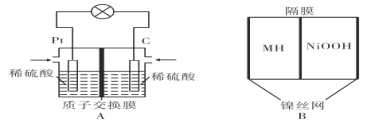
【题目】氢能是一种新型能源,氢氧燃料电池的能量转化效率高。某学习小组设计如图A所示的氢氧燃料电池装置,电流由石墨极(C极)经外电路流向铂极(Pt极)。
请回答下列问题:
(1)向图A装置中充入氢气的一极是____(填“铂极”或“石墨极”),电子流向是________
(2)A装置在能量转化过程中,负极的电极反应式为________
(3)若A装置消耗11.2L氧气(标准状况),理论上有____molH+从交换膜________侧向________侧迁移(填“左”或“右”)。
(4)某金属合金是优质储氢材料,金属氢化物镍电池(MH-Ni电池)具有广泛应用价值。如图B以KOH为电解质,电池反应为NiOOH+MH![]() Ni(OH)2+M。在放电时正极的电极反应式为________。
Ni(OH)2+M。在放电时正极的电极反应式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有如图原电池装置,插入电解质溶液前Cu和Fe电极的质量相等。
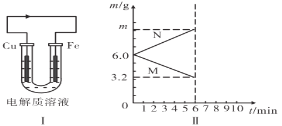
(1)当电解质溶液为稀硫酸时,铁片作________极,铜片上的现象是________.图I中箭头的方向表示__________(填“电子”或“电流”)的流向。
(2)当电解质溶液为某溶液时,两极(用M、N表示)的质量变化曲线如图II所示,则该电解质溶液可以是下列中的________(填代号)。
A.稀硫酸 B.CuSO4溶液 C.稀盐酸 D.FeSO4溶液
若电解液为所选溶液,则电极N的电极反应式为________,溶液中阳离子移动方向是________,m=________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g) 达到平衡。下列说法正确的是
CH3OH(g) 达到平衡。下列说法正确的是
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c(H+) | c(CO) | c(CH3OH) | c(CH3OH) | ||
Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
Ⅱ | 400 | 0.40 | 0.20 | 0 | |
Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
A. 该反应的逆反应放热
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C. 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,在20 mL 0.1 mol·L-1一元弱酸HA溶液中滴加0. 1 mol· L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]与pH关系如图所示。下列说法正确的是

A. A点对应溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
B. 25℃时,HA酸的电离常数为1. 0× 10-5.3
C. B点对应的NaOH溶液体积为10 mL
D. 对C点溶液加热(不考虑挥发),则c(A-)/[c(HA)c(OH-)]一定增大
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将HC1气体通入到1L浓度均为0.1mol/L的NaA和NaB的混合溶液中,混合溶液的pH与离子浓度变化的关系如图所示(忽略溶液体积的变化)。下列叙述不正确的是
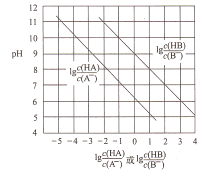
A. Ka(HB)的数量级为10-9
B. 酸性的强弱顺序为HCl>HA>HB
C. 当通入0.1molHC1气体时,c(B-)>c(A-)
D. 当混合溶液呈中性时,c(Na+)=c(Cl-)+c(A-)+c(B-)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)1807年,英国化学家戴维在研究中发现:电解条件下可把水分解成H2和O2。他设想用电解的方法从KOH、NaOH中分离出K和Na。最初,戴维用饱和KOH溶液进行电解,不料还是得到H2和O2。这时,他考虑在无水条件下继续这项实验,但是,实验中产生的金属液珠一接触空气就立即燃烧起来;这时,他又考虑在________条件下电解熔融的KOH继续实验,最后他终于成功地得到了银白色的金属钾。
(2)最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,质量数是85。根据材料回答下列问题:
Ⅰ.铷位于元素周期表的第________周期________族。
Ⅱ.关于铷的下列说法中正确的是________(填序号,下同)。
①与水反应比钠更剧烈 ②Rb2O在空气中易吸收水和二氧化碳 ③Rb2O2与水能剧烈反应并释放出O2④它是极强的还原剂 ⑤RbOH的碱性比同浓度的NaOH弱
Ⅲ.现有铷和另一种碱金属形成的合金5g,与足量水反应时生成标准状况下的气体2.24 L,则另一碱金属可能是________(填元素符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com