
【题目】现有如图原电池装置,插入电解质溶液前Cu和Fe电极的质量相等。
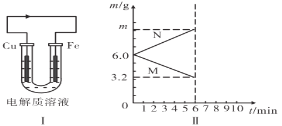
(1)当电解质溶液为稀硫酸时,铁片作________极,铜片上的现象是________.图I中箭头的方向表示__________(填“电子”或“电流”)的流向。
(2)当电解质溶液为某溶液时,两极(用M、N表示)的质量变化曲线如图II所示,则该电解质溶液可以是下列中的________(填代号)。
A.稀硫酸 B.CuSO4溶液 C.稀盐酸 D.FeSO4溶液
若电解液为所选溶液,则电极N的电极反应式为________,溶液中阳离子移动方向是________,m=________g。
【答案】负 有无色气体生成 电流 B Cu2++2e-=Cu 从M极流向N极 9.2
【解析】
(1)当电解质溶液为稀硫酸时,铁比铜活泼,铁为负极,发生电极反应为Fe-2e-=Fe2+,铜为正极,氢离子在正极上得电子转化为氢气,电极反应为:2H++2e-=H2↑,电子经过导线由负极流向正极;
(2)当电解质溶液为某溶液时,两极(用M、N表示)的质量变化曲线如图II所示可知,N电极的质量增加,M电极的质量减少,据此分析解答。
(1)根据分析,当电解质溶液为稀硫酸时,铁片为负极,铜片为正极,氢离子在正极上得电子转化为氢气,电极反应为:2H++2e-=H2↑,正极上的现象是有无色气体生成;原电池中电子经过导线由负极流向正,电流的方向与电子流向相反,极图I中箭头的方向由正极指向负极,则表示的为电流的流向;
(2)当电解质溶液为某溶液时,两极(用M、N表示)的质量变化曲线如图II所示可知,N电极的质量增加,M电极的质量减少,
A.若稀硫酸为电解质溶液时,铁为负极,电极反应为:Fe-2e-=Fe2+,铜为正极,电极反应为:2H++2e-=H2↑,铁电极质量减少,铜电极质量不变,故A不符合题意;
B.若CuSO4溶液为电解质溶液时,铁为负极,电极反应为:Fe-2e-=Fe2+,铜为正极,电极反应为:Cu2++2e-=Cu,铁电极质量减少,铜电极质量增大,故B符合题意;
C.若稀盐酸为电解质溶液时,铁为负极,电极反应为:Fe-2e-=Fe2+,铜为正极,电极反应为:2H++2e-=H2↑,铁电极质量减少,铜电极质量不变,故C不符合题意;
D.若FeSO4溶液为电解质溶液时,不能形成自发进行的氧化还原反应,不能构成原电池,铁电极和铜电极质量不变,故D不符合题意;
答案选B;
若电解液为CuSO4溶液,铁电极质量减少,铜电极质量增大,结合图示,则电极N代表铜电极,为正极,电极反应式为Cu2++2e-=Cu,M代表铁电极,为负极;原电池中,阳离子向正极移动,则溶液中阳离子移动方向是从M极流向N极,根据图示,M电极减少的质量=6g-3.2g=2.8g,即铁电极的质量减少2.8g,消耗铁电极的物质的量为![]() =0.05mol,根据电极反应:Fe-2e-=Fe2+、Cu2++2e-=Cu可知,消耗1mol铁电极转移2mol电子,同时生成1mol铜,则消耗0.05mol铁电极,转移0.1mol电子,生成0.05mol铜,则铜电极增加的质量=0.05mol×64g/mol=3.2g,则m=3.2g+6g=9.2g。
=0.05mol,根据电极反应:Fe-2e-=Fe2+、Cu2++2e-=Cu可知,消耗1mol铁电极转移2mol电子,同时生成1mol铜,则消耗0.05mol铁电极,转移0.1mol电子,生成0.05mol铜,则铜电极增加的质量=0.05mol×64g/mol=3.2g,则m=3.2g+6g=9.2g。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】下图六个操作是常见物质的分离提纯操作,则有关这的说法不正确的是


A. 操作1、操作2、操作6都可以是蒸馏,也可以是蒸发
B. 操作2可以是蒸发浓缩、冷却结晶、过滤
C. 操作3可以是洗剂、干燥
D. 操作4、操作5分别是萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用溢流法连续制备无水四氯化锡(SnCl4)。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置图如图:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH=–511kJmol-1
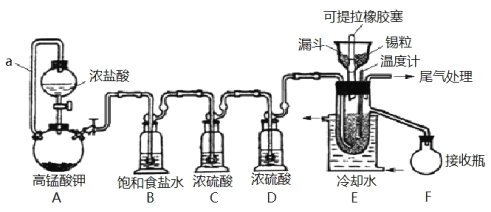
可能用到的有关数据如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
制备过程中,锡粒逐渐被消耗,需提拉橡胶塞及时向反应器中补加锡粒。当SnCl4液面升至侧口高度时,液态产物经侧管流入接收瓶。回答下列问题:
(1)a的作用是___。
(2)A中反应的化学方程式是___。
(3)B的作用是___。
(4)E中冷却水的作用是___。
(5)尾气处理时,可选用的装置是___(填序号)。
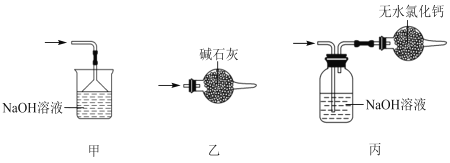
(6)锡粒中含铜杂质致 E 中产生 CuCl2,但不影响 F 中产品的纯度,原因是___。
(7)SnCl4粗品中含有Cl2,精制时加入少许锡屑后蒸馏可得纯净的SnCl4。蒸馏过程中不需要用到的仪器有___(填序号)
A.分液漏斗 B.温度计 C.吸滤瓶 D.冷凝管 E.蒸馏烧瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) ![]() CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )

A. 该反应的ΔH>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时一定有v正<v逆
D. 在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体。火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题:
①如图是一定量丙烷完全燃烧生成CO2和1molH2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“” ___。
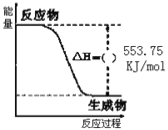
②写出表示丙烷燃烧热的热化学方程式:___。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为___。
(2)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知:H2O(g)═H2O(l) △H1=Q1kJ/mol
C2H5OH(g)═C2H5OH(l) △H2=Q2kJ/mol
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g) △H3=Q3kJ/mol
若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为___kJ。
②碳(s)在氧气供应不充分时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s)+![]() O2(g)═CO(g)的△H.但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有___。
O2(g)═CO(g)的△H.但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)ASH3的电子式为___;AsH3通入AgNO3溶液中可生成Ag, As2 O3和HNO3,该反应中氧化剂与还原剂的物质的量之比为___。
(2)改变O. 1 mol · L-1三元弱酸H3 AsO4溶液的pH,溶液中的H3 AsO4、H2 AsO4-、HAsO42-以及AsO43-的物质的量分布分数随pH的变化如图所示:

①1gKal ( H3 AsO4)=___;用甲基橙作指示剂,用NaOH溶液滴定H3 ASO4发生的主要反应的离子方程式为___
②反应H2 AsO4-+AsO43-=2HAsO42-的lgK=_____
(3)焦炭真空冶炼砷的其中两个热化学反应如下:
As2O3(g)+3C(s)=2As(g)+3CO(g) ![]() H1=akJ/mol
H1=akJ/mol
As2O3(g)+3C(s)=1/2As4(g)+3CO(g) ![]() H2=bkJ/mol
H2=bkJ/mol
则反应4As(g)=As4(g)![]() H=_______kJ/mol(用含a、b的代数式表示)。
H=_______kJ/mol(用含a、b的代数式表示)。
(4)反应2As2S3(s)=4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:

①对应温度下,B点的反应速率v(正) ___v(逆)(填“>’,’’<”或“一”)。
②A点处,AsS(g)的分压为___kPa,该反应的Kp=___kPa5 (Kp为以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有H、D、T三种原子,各自可形成双原子分子H2、D2、T2,请填写下列各题。
①标准状况下,它们的密度之比为_____。
②相同物质的量的三种单质中,质子数之比为_____。
③各1g三种单质中,它们的质子数之比为_____。
④同温同压下,1LD2和T2气体中所含中子数之比_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体经过如图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )
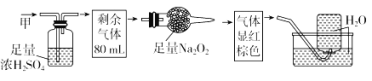
A. NH3、NO2、N2B. NH3、NO、CO2
C. NH3、NO2、CO2D. NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(l)氟代硼酸钾中各元素原子的第一电离能大小顺序是F>O>___。基态K+电子占据最高能级的电子云轮廓图为___形。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是___,中心原子的杂化形式为___。NaBH4中存在___(填标号)。
a.离子键 b.氢键 c.![]() 键 d.
键 d.![]() 键
键
(3)BeC12中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为___,其中Be的配位数为___。
(4)第三周期元素氟化物的熔点如下表:
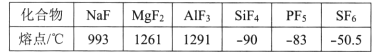
解释表中氟化物SiF4 、PF5、SF6熔点变化的原因:___。
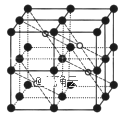
(5)CaF2的一种晶胞如图所示。若r(F-)=xpm,r(Ca2+) =ypm,设阿伏加德罗常数的值为NA,则CaF2的密度![]() =___g·cm-3(列出计算表达式)。
=___g·cm-3(列出计算表达式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com