
【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(l)氟代硼酸钾中各元素原子的第一电离能大小顺序是F>O>___。基态K+电子占据最高能级的电子云轮廓图为___形。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是___,中心原子的杂化形式为___。NaBH4中存在___(填标号)。
a.离子键 b.氢键 c.![]() 键 d.
键 d.![]() 键
键
(3)BeC12中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为___,其中Be的配位数为___。
(4)第三周期元素氟化物的熔点如下表:
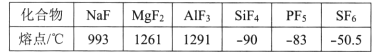
解释表中氟化物SiF4 、PF5、SF6熔点变化的原因:___。
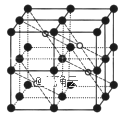
(5)CaF2的一种晶胞如图所示。若r(F-)=xpm,r(Ca2+) =ypm,设阿伏加德罗常数的值为NA,则CaF2的密度![]() =___g·cm-3(列出计算表达式)。
=___g·cm-3(列出计算表达式)。
【答案】Be>B>K 哑铃 正四面体 sp3 ac ![]() 3 SiF4 、PF5、SF6均属于分子化合物,且分子间均无氢键,其范德华力(或分子间作用力)逐渐增加
3 SiF4 、PF5、SF6均属于分子化合物,且分子间均无氢键,其范德华力(或分子间作用力)逐渐增加 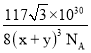
【解析】
(1)氟代硼酸钾(KBe2BO3F2)中含有元素K、Be、B、O、F,根据同周期元素第一电离能逐渐增大的趋势以及全满半满导致反常可知,第一电离能大小关系为:F>O>Be>B>K,基态K+最高能级符号为3p,其电子云轮廓图为哑铃形,
故答案为:Be>B>K;哑铃;
(2)NaBH4中阴离子为BH4-,其成键电子对为4,孤电子对为![]() =0
=0
,故其空间构型为正四面体,其中心原子杂化形式为sp3,NaBH4为离子化合物,含有离子键,其阴离子中化学键全部为单键,即全部为![]() 键,不含有氢键和
键,不含有氢键和![]() 键,因此选ac,
键,因此选ac,
故答案为:正四面体;sp3;ac;
(3)BeC12的双聚分子为Be2Cl4,其结构式为:![]() ,由其结构式可知,Be的配位数为3,
,由其结构式可知,Be的配位数为3,
故答案为:![]() ;3;
;3;
(4)SiF4 、PF5、SF6均属于分子化合物,且分子间均无氢键,其范德华力逐渐增加,其熔点逐渐升高,
故答案为:SiF4 、PF5、SF6均属于分子化合物,且分子间均无氢键,其范德华力(或分子间作用力)逐渐增加;
(5)该晶胞中黑球个数为:![]() =8,白球个数为4,故一个晶胞中含有4个CaF2“分子”,该晶胞的质量为:
=8,白球个数为4,故一个晶胞中含有4个CaF2“分子”,该晶胞的质量为:![]() g,设该晶胞边长为acm,该晶胞的体对角线为
g,设该晶胞边长为acm,该晶胞的体对角线为![]() a=4×(x+y)×10-10cm,解得a=
a=4×(x+y)×10-10cm,解得a=![]() cm,该晶胞密度
cm,该晶胞密度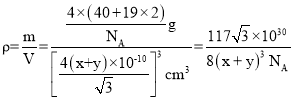 g·cm-3,
g·cm-3,
故答案为: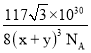 。
。


科目:高中化学 来源: 题型:
【题目】现有如图原电池装置,插入电解质溶液前Cu和Fe电极的质量相等。
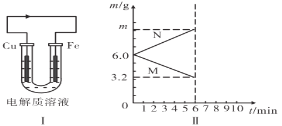
(1)当电解质溶液为稀硫酸时,铁片作________极,铜片上的现象是________.图I中箭头的方向表示__________(填“电子”或“电流”)的流向。
(2)当电解质溶液为某溶液时,两极(用M、N表示)的质量变化曲线如图II所示,则该电解质溶液可以是下列中的________(填代号)。
A.稀硫酸 B.CuSO4溶液 C.稀盐酸 D.FeSO4溶液
若电解液为所选溶液,则电极N的电极反应式为________,溶液中阳离子移动方向是________,m=________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制960 mL 0.3mol/L NaOH溶液。具体如下:
(1)需称取_________g NaOH。
(2)配制过程中除烧杯、托盘天平、玻璃棒,还需要用到主要玻璃仪器是__________。
(3)下列操作会使配制的溶液浓度偏低的是___________(填字母)。
A、配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体
B、配制氢氧化钠溶液时,容量瓶中有少量水
C、发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线
D、定容时俯视容量瓶刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如下转化关系:
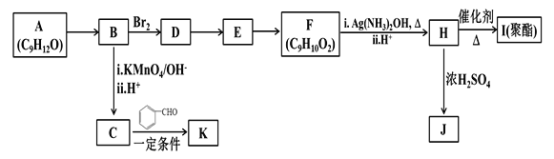
已知以下信息:
①A是芳香族化合物且分子侧链上有处于两种不同环境下的氢原子;
②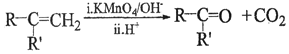
③RCOCH3+RCHO![]() RCOCH=CHR
RCOCH=CHR
回答下列问题:
(1)A生成B的反应类型为________,由D生成E的反应条件为________。
(2)H 的官能团名称为________。
(3)I的结构简式为_______。
(4)由E生成F的反应方程式为________ 。
(5)F有多种同分异构体,写出一种符合下列条件的同分异构体的结构简式为_______。
①能发生水解反应和银镜反应;②属于芳香族化合物且分子中只有一个甲基;
③具有5个核磁共振氢谱峰
(6)糠叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(![]() )为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
)为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() 均为主族元素,分析表中数据,判断下列说法正确的是(
均为主族元素,分析表中数据,判断下列说法正确的是(![]() )( )
)( )
元素 |
|
|
|
最外层电子数 |
| b | a |
原子半径/ | 0.152 | 0.143 | 0.186 |
A.![]() 与
与![]() 位于同一主族,且
位于同一主族,且![]() 在
在![]() 的上一周期
的上一周期
B.![]() 与
与![]() 位于同一主族,且
位于同一主族,且![]() 在
在![]() 的下一周期
的下一周期
C.![]() 与
与![]() 位于同一周期,且
位于同一周期,且![]() 的原子序数小于
的原子序数小于![]() 的原子序数
的原子序数
D.![]() 与
与![]() 位于同一主族,且
位于同一主族,且![]() 的原子序数小于
的原子序数小于![]() 的原子序数
的原子序数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L密闭容器中通入2mol氨气,在一定温度下,发生下列反应:2NH3 ![]() N2+3H2,达到平衡时,容器内N2的百分含量为a%,若维持容器的体积和温度都不变,分别通入下列几组物质,达到平衡时,容器内N2的含量仍为a%的是( )
N2+3H2,达到平衡时,容器内N2的百分含量为a%,若维持容器的体积和温度都不变,分别通入下列几组物质,达到平衡时,容器内N2的含量仍为a%的是( )
A.3molH2和1molN2B.2molNH3和1molN2
C.2molN2和3molH2D.0.1molNH3,0.95molN2和2.85molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 四种元素原子的核电荷数依次增大,它们的简单离子的电子层数相同且最外层电子数均为8,
四种元素原子的核电荷数依次增大,它们的简单离子的电子层数相同且最外层电子数均为8,![]() 元素原子的
元素原子的![]() 层电子数与
层电子数与![]() 、
、![]() 层电子数之和相等,
层电子数之和相等,![]() 元素原子的
元素原子的![]() 、
、![]() 层电子数之和等于电子总数的一半。试回答下列问题。
层电子数之和等于电子总数的一半。试回答下列问题。
(1)四种元素的符号依次是![]() ______,
______,![]() ______,
______,![]() ______,
______,![]() ______;它们的原子半径由大到小的顺序是______(用元素符号表示)。
______;它们的原子半径由大到小的顺序是______(用元素符号表示)。
(2)试写出四种元素的离子结构示意图:![]() ______,
______,![]() ______,
______,![]() ______,
______,![]() ______。它们的离子半径由大到小的顺序是______(用离子符号表示)。
______。它们的离子半径由大到小的顺序是______(用离子符号表示)。
(3)分别写出四种元素的最高价氧化物对应水化物的化学式:______。
(4)分别写出![]() 、
、![]() 两元素的气态氢化物的化学式:______。
两元素的气态氢化物的化学式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组利用下列实验装置探究氯气与过量氨气反应的实验,有关说法不正确的是
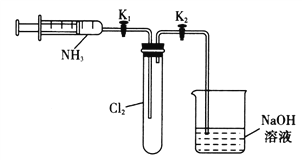
A. 打开K1,关闭K2,将注射器的活塞往外拉一小段,然后松开,活塞复原,说明装置气密性良好
B. 打开K1,推动注射器的活塞使过量的氨气与氯气混合时,产生大量的白色烟雾
C. 充分反应后,关闭K1,打开K2,可观察到烧杯中的溶液会倒吸至试管内
D. 实验室制备氨气和氯气可以用同一套发生装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的
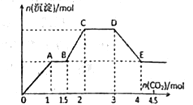
A. CD段的离子方程式可以表示为:CO32-+CO2+H2O═2HCO3-
B. 肯定不存在的离子是SO42-、OH-
C. 该溶液中能确定存在的离子是Ba2+、AlO2-、NH4+
D. OA段反应的离子方程式:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com