
【题目】在1L密闭容器中通入2mol氨气,在一定温度下,发生下列反应:2NH3 ![]() N2+3H2,达到平衡时,容器内N2的百分含量为a%,若维持容器的体积和温度都不变,分别通入下列几组物质,达到平衡时,容器内N2的含量仍为a%的是( )
N2+3H2,达到平衡时,容器内N2的百分含量为a%,若维持容器的体积和温度都不变,分别通入下列几组物质,达到平衡时,容器内N2的含量仍为a%的是( )
A.3molH2和1molN2B.2molNH3和1molN2
C.2molN2和3molH2D.0.1molNH3,0.95molN2和2.85molH2
【答案】AD
【解析】
反应2NH33H2+N2,在恒温恒容下,达到平衡时,容器内N2的百分含量也为a%,说明与原平衡是等效平衡,按化学计量数转化到方程式的左边,满足n(NH3)=2mol即可,据此进行分析。
根据等效平衡,按化学计量数转化到方程式的左边,满足n(NH3)=2mol,则达到平衡时,容器内N2的百分含量为a%,
A.3molH2+1molN2按化学计量数转化到方程式的左边可得:n(NH3)=2mol,与初始量2molNH3相同,属于等效平衡,故A符合题意;
B.2molNH3+1molN2与初始量2molNH3不相同,则不属于等效平衡,达到平衡时,容器内N2的百分含量不是a%,故B不符合题意;
C.2molN2+3molH2按化学计量数转化到方程式的左边,可得:n(NH3)=2mol、n(N2)=1mol,与初始加入物质不同,不是等效平衡,故C不符合题意;
D.0.1molNH3+0.95molN2+2.85molH2,按化学计量数转化到方程式的左边可得:n(NH3)=2mol,与初始量2molNH3相同,属于等效平衡,故D符合题意;
答案选AD。


科目:高中化学 来源: 题型:
【题目】砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)ASH3的电子式为___;AsH3通入AgNO3溶液中可生成Ag, As2 O3和HNO3,该反应中氧化剂与还原剂的物质的量之比为___。
(2)改变O. 1 mol · L-1三元弱酸H3 AsO4溶液的pH,溶液中的H3 AsO4、H2 AsO4-、HAsO42-以及AsO43-的物质的量分布分数随pH的变化如图所示:

①1gKal ( H3 AsO4)=___;用甲基橙作指示剂,用NaOH溶液滴定H3 ASO4发生的主要反应的离子方程式为___
②反应H2 AsO4-+AsO43-=2HAsO42-的lgK=_____
(3)焦炭真空冶炼砷的其中两个热化学反应如下:
As2O3(g)+3C(s)=2As(g)+3CO(g) ![]() H1=akJ/mol
H1=akJ/mol
As2O3(g)+3C(s)=1/2As4(g)+3CO(g) ![]() H2=bkJ/mol
H2=bkJ/mol
则反应4As(g)=As4(g)![]() H=_______kJ/mol(用含a、b的代数式表示)。
H=_______kJ/mol(用含a、b的代数式表示)。
(4)反应2As2S3(s)=4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:

①对应温度下,B点的反应速率v(正) ___v(逆)(填“>’,’’<”或“一”)。
②A点处,AsS(g)的分压为___kPa,该反应的Kp=___kPa5 (Kp为以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法全部正确的是( )
①环丙烷和乙烯的最简式相同②相同质量的乙炔和苯充分燃烧耗氧量相同
③苯乙烯和丁烯互为同系物④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2 L的己烷所含的分子数为0.5NA(NA为阿伏加德罗常数的值)
⑥![]() 分子中所有原子一定都在同一平面上
分子中所有原子一定都在同一平面上
A. ①②③B. ②④⑤⑥
C. ①②④D. ①②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期律的叙述正确的是( )
A.随着元素原子序数的递增,原子最外层电子数从1到8(第1周期元素及过渡元素除外)重复出现
B.随着元素原子序数的递增,元素最高正化合价从+1到+7、负化合价从-7到-1重复出现
C.随着元素原子序数的递增,原子(稀有气体元素原子除外)半径从小到大发生周期性变化
D.元素性质的周期性变化是元素原子核外电子排布周期性变化的必然结果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(l)氟代硼酸钾中各元素原子的第一电离能大小顺序是F>O>___。基态K+电子占据最高能级的电子云轮廓图为___形。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是___,中心原子的杂化形式为___。NaBH4中存在___(填标号)。
a.离子键 b.氢键 c.![]() 键 d.
键 d.![]() 键
键
(3)BeC12中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为___,其中Be的配位数为___。
(4)第三周期元素氟化物的熔点如下表:
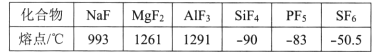
解释表中氟化物SiF4 、PF5、SF6熔点变化的原因:___。
(5)CaF2的一种晶胞如图所示。若r(F-)=xpm,r(Ca2+) =ypm,设阿伏加德罗常数的值为NA,则CaF2的密度![]() =___g·cm-3(列出计算表达式)。
=___g·cm-3(列出计算表达式)。
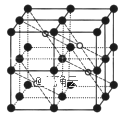
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是丁醇的两种同分异构体,其结构简式、沸点及熔点如下表所示:
异丁醇 | 叔丁醇 | |
结构简式 |
|
|
沸点/℃ | 108 | 82.3 |
熔点/℃ | -108 | 25.5 |
下列说法不正确的是
A. 用系统命名法给异丁醇命名为:2-甲基-1-丙醇
B. 异丁醇的核磁共振氢谱有三组峰,且面积之比是1∶2∶6
C. 用蒸馏的方法可将叔丁醇从二者的混合物中分离出来
D. 两种醇发生消去反应后得到同一种烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、Al2O3等杂质。工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:
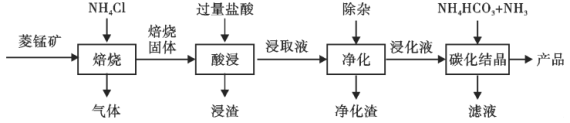
已知:MnCO3+2NH4Cl=MnCl2+CO2↑+2NH3↑+H2O.
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 |
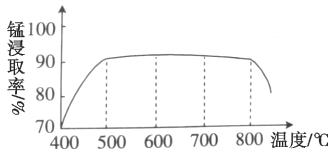
(1)焙烧时温度对锰浸取率的影响如图。焙烧时适宜的温度为___________左右;800℃以上锰的浸取率偏低,可能的原因是___________。
(2)净化包含三步:①加入少量MnO2,添加少量MnO2的作用是____________。发生反应的离子方程式为___________。
②加氨水调pH,溶液的pH范围应调节为___________~8.1之间。生成的沉淀主要是___________。
③加入MnF2,沉淀除去Ca2+,若溶液酸度过高,Ca2+沉淀不完全,原因是___________。
(3)碳化结晶中生成MnCO3的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用H2O2和H2SO4的混合溶液可腐蚀印刷电路板上的铜,其热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) ΔH
已知①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH1=64kJ·mol-1
②2H2O2(l)=2H2O(l)+O2(g) ΔH2=-196kJ·mol-1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=-286kJ·mol-1
O2(g)=H2O(l) ΔH3=-286kJ·mol-1
下列说法不正确的是( )
A.反应①可通过铜作电极电解稀的H2SO4方法实现
B.反应②在任何条件下都能自发进行
C.若H2(g)+![]() O2(g)=H2O(g) ΔH4,则ΔH4<ΔH3
O2(g)=H2O(g) ΔH4,则ΔH4<ΔH3
D.ΔH=-320kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅是一种化工原料,可以制备一系列物质。下列说法正确的是( )
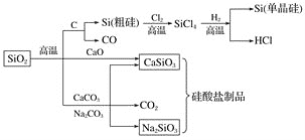
A.图中所有反应都不属于氧化还原反应
B.硅酸盐的化学性质稳定,常用于制造光导纤维
C.可用盐酸除去石英砂(主要成分为SiO2)中少量的碳酸钙
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com