
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 在标准状况下,11.2L HF含有的分子数目为0.5NA
B. 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子
C. 常温下,0.2 L 0.5 mol·L-1 NH4NO3溶液中含有的氮原子数小于0.2NA
D. 18g葡萄糖(C6H12O6)分子含有的羟基数目为0.6NA
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用废镍催化剂(主要成分为Ni,还含有一定量的Zn、Fe、SiO2、CaO)制备草酸镍晶体(NiC2O4·2H2O)的流程如下:

(1)NiC2O4·2H2O中C的化合价是___。既能加快“酸浸”反应速率又能提高“酸浸”原料利用率的操作措施为___。
(2)“滤渣Ⅰ”的主要成分是___。
(3)在隔绝空气的条件下,高温煅烧无水NiC2O4得到Ni2O3和两种含碳元素的气体,该反应的化学方程式是___。
(4)高能锂离子电池的总反应为2Li+FeS=Fe+Li2S。用该电池作电源电解含镍酸性废水回收Ni的装置如图(图中X、Y为电极,LiPF6·SO(CH3)2为电解质)。
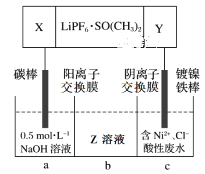
①电极X的反应材料是___(填化学式);中间隔室b可以得到的主要物质Z是___(填化学式)。
②电解总反应的离子方程式为___。
已知F=96500C/mol,若电池工作tmin,维持电流强度为I A,理论回收Ni___g(写出计算表达式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y、Z都是短周期的元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上气态化合物,则
(1)X的化学式是_____、Y的化学式是_____、Z的名称是_____。
(2)由Y和Z组成,且Y和Z质量比为7:20的化合物的化学式(分子式)是_____。
(3)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的一种阳离子是_____。
(4)由X、Y、Z元素按原子个数比为4:2:3组成的化合物,该化合物的化学式(分子式)是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】有H、D、T三种原子,各自可形成双原子分子H2、D2、T2,请填写下列各题。
①标准状况下,它们的密度之比为_____。
②相同物质的量的三种单质中,质子数之比为_____。
③各1g三种单质中,它们的质子数之比为_____。
④同温同压下,1LD2和T2气体中所含中子数之比_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气中的有害气体主要有NO、碳氢化合物及CO,某校同学设计实验将模拟汽车尾气转化为无害气体。回答下列问题;

(1)为了配制模拟尾气,甲组同学用上图所示装置分别制备NO、乙烯及CO三袋气体。
①用装置A制取NO,分液漏斗中盛放的是___(填试剂名称)。
②用 (乙烯利)与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为______(磷转化为Na3 PO4)。
(乙烯利)与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为______(磷转化为Na3 PO4)。
③用H2 C2 O4与浓硫酸制取CO(化学方程式为H2C2O4 ![]() CO+CO2+H2O并提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为___→g(气流从左至右),其中装置D中盛放的药品是___
CO+CO2+H2O并提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为___→g(气流从左至右),其中装置D中盛放的药品是___
(2)乙组同学将甲组制得的气体与空气按适当比例混合形成模拟尾气(NO,CO,C2 H4及空气),按如图所示 装置进行尾气转化并检验。

①为检验催化反应后的气体中是否有CO2生成和乙烯的残留,G、H中盛放的试剂依次是_________(填标号)。
a. NaOH溶液 b.酸性KMnO4溶液
c.澄清石灰水 d. Br2/CCl4溶液
②通“模拟尾气”前,需先将催化剂加热到反应所需的温度,其目的是___;写出其中CO与NO完全转化为无害气体的化学方程式:___
查看答案和解析>>
科目: 来源: 题型:
【题目】美托洛尔可用于治疗各类型高血压及心绞痛,其一种合成路线如下:

已知:①CH3COCH2R![]() CH3CH2CH2R
CH3CH2CH2R
② B- F苯环上均只有两个取代基
回答下列问题:
(1)A的化学名称是___,C中含氧官能团的名称是___
(2)E→F的反应类型是___,G的分子式为___。
(3)D的结构简式为___。
(4)反应B→C的化学方程式为___
(5)芳香族化合物W是G的同分异构体,W能发生水解反应,核磁共振氢谱有4组峰,峰面积之比为9:3:2:2,写出一种符合要求的W的结构简式:___.
(6)4一苄基苯酚( )是一种药物中间体,请设计以苯甲醇和苯酚为原料制备4-苄基苯酚的合成路线:______(无机试剂任用)。
)是一种药物中间体,请设计以苯甲醇和苯酚为原料制备4-苄基苯酚的合成路线:______(无机试剂任用)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将MnO2与FeSO4溶液、硫酸充分反应后过滤,将滤液加热至60℃后,再加入Na2CO3溶液,最终可制得碱式碳酸锰[aMnCO3·bMn(OH)2·cH2O]。
(1)用废铁屑与硫酸反应制备FeSO4溶液时,所用铁屑需比理论值略高,原因是 ,反应前需将废铁屑用热Na2CO3溶液浸泡,其目的是 。
(2)为测定碱式碳酸锰组成,取7.390 g样品溶于硫酸,生成CO2 224.0 mL(标准状况),并配成500 mL溶液。准确量取10.00 mL该溶液,用0.0500 mol·L-1 EDTA(化学式Na2H2Y)标准溶液滴定其中的Mn2+(原理为Mn2+ +H2Y2-=MnY2-+2H+),至终点时消耗EDTA标准溶液28.00 mL。通过计算确定该样品的化学式。(写出计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】多尺度复杂化学系统模型可以用量子化学计算小区间内(如生物固氮时固氮酶中)的化学反应。
(1)固氮酶有铁蛋白和钼铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将环境底物乙炔催化还原成乙烯。
①乙炔是__________(填“非极性”或“极性”)分子。
②碳负离子CH3-的立体构型为____________。
③根据等电子原理,NO+的电子式为________________。
(2)钒可用于合成电池电极,也可用于人工合成二价的钒固氮酶(结构如图a)。
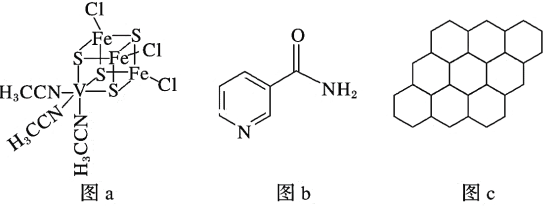
①V2+基态时核外电子排布式为____________________________________________。
②钒固氮酶中钒的配位原子有_____________________________(填元素符号)。
(3)烟酰胺(结构如图b)可用于合成光合辅酶NADPH,烟酰胺分子中氮原子的杂化轨道类型有_______________________,1 mol该分子中含σ键的数目为________。
(4)12 g石墨烯(结构如图c)中含有的正六边形数目约为________;请你预测硅是否容易形成类似石墨烯的结构,并说明理由:___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用二氧化碳生产化工产品,有利于二氧化碳的大量回收。二氧化碳和乙二醇在ZnO或锌盐催化下可合成碳酸乙烯酯。
CO2+![]()
![]()
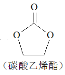 +H2O
+H2O
(1)锌基态原子核外电子排布式为_________;写出一种与CO2互为等电子体的分子的化学式:__________。
(2)锌盐水溶液中Zn2+可与H2O之间形成 [Zn(H2O)6]2+,提供空轨道的是_____(填微粒符号)。
(3)碳酸乙烯酯中碳原子杂化轨道类型为______;1mol碳酸乙烯酯中含有的![]() 键数目为______。
键数目为______。
(4)生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是____________;
②甲醛分子的空间构型是______________(用文字描述);
(5)抗坏血酸的分子结构如图 1 所示,推测抗坏血酸在水中的溶解性:______(填“难溶于水”或“易溶于水”) ;一个Cu2O 晶胞(见图 2)中,Cu 原子的数目为______ 。
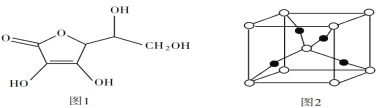
查看答案和解析>>
科目: 来源: 题型:
【题目】氮、铬及其相关化合物用途非常广泛。回答下列问题:
(1)基态N原子的核外电子排布式为___,Cr位于元素周期表第四周期___族。
(2) Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为___;Crcl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为___。
(3) Cr的一种配合物结构如图所示:

①阴离子C1O4-的空间构型为___形。
②配离子中,中心离子的配位数为___,N与中心原子形成的化学键称为___键。
③配体H2 NCH2 CH2 NH2(乙二胺)中碳原子的杂化方式是______ ,分子中三种元素电负性从大到小的顺序为___
(4)氮化铬的熔点为1770℃,它的一种晶体的晶胞结构如图所示,其密度为5. 9 g·cm -3,氮化铬的晶胞边长为___(列出计算式)nm.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com