
科目: 来源: 题型:
【题目】随着现代科学技术的快速发展,防腐蚀技术也在不断提高。
Ⅰ.金属的腐蚀原理
(1)中性环境中多为吸氧腐蚀,其正极的电极反应为________。
(2)析氢腐蚀和吸氧腐蚀的均会导致体系中c(OH-)________(填“增大”、“不变”或“减小”)。
(3)不同酸性介质中,金属腐蚀原理并不相同。下图是密闭容器中,生铁在pH=2和pH=4的盐酸中压强随时间的变化过程。
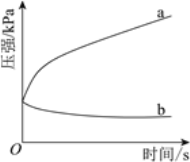
图中代表pH=2的曲线是________(填“a”或“b”)。
Ⅱ.金属的电化学防护
(1) 富锌涂料是使用广泛的防锈底漆,涂层中锌对钢铁保护的原理是________。
(2) 缓蚀剂是能明显减缓或阻止金属腐蚀的物质,钼酸钠(Na2MoO4)和磷酸二氢锌[Zn(H2PO4)]2是常用自来水(pH范围6.5~8.8)介质碳钢缓蚀剂。
①钼酸钠(Na2MoO4)在电极表面被还原为MoO2形成保护膜,减缓腐蚀,该电极反应为______;同时,MoO42-能与Fe2+反应生成难溶的Fe2O3和MoO2,沉积在碳钢表面减缓腐蚀。写出MoO42-与Fe2+反应的离子反应方程式:_______。
②电化学反应可使缓蚀剂成分中的Zn(H2PO4)2转化为难溶性的Zn3(PO4)2,形成保护膜,减缓腐蚀。用平衡移动原理解释发生转化原因________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已如反应:CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g) +HCl(g)。在一定压强下,按ω=
CH2=CHCH2Cl(g) +HCl(g)。在一定压强下,按ω=![]() 向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ) 与温度(T)、ω 的关系,图乙表示逆反应的平衡常数与温度的关系。则下列说法错误的是
向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ) 与温度(T)、ω 的关系,图乙表示逆反应的平衡常数与温度的关系。则下列说法错误的是

A. 图甲中,ω2>1
B. 图乙中,A线表示逆反应的平衡常数
C. 温度T1、ω=2时,Cl2的转化率为50%
D. 若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强将增大
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组以4H++4I-+O2=2I2+2H2O为研究对象,探究影响氧化还原反应因素。
实验 | 气体a | 编号及现象 |
| HCl | Ⅰ.溶液迅速呈黄色 |
SO2 | Ⅱ.溶液较快呈亮黄色 | |
CO2 | Ⅲ.长时间后,溶液呈很浅的黄色 | |
空气 | Ⅳ.长时间后,溶液无明显变化 |
(1)实验Ⅳ的作用是______________。用CCl4萃取Ⅰ、Ⅱ、Ⅲ、Ⅳ的溶液,萃取后下层CCl4的颜色均无明显变化。
(2)取萃取后上层溶液,用淀粉检验:Ⅰ、Ⅲ的溶液变蓝;Ⅱ、Ⅳ的溶液未变蓝。溶液变蓝说明Ⅰ、Ⅲ中生成了______________。
(3)查阅资料:I2易溶于KI溶液。下列实验证实了该结论并解释Ⅰ、Ⅲ的萃取现象。
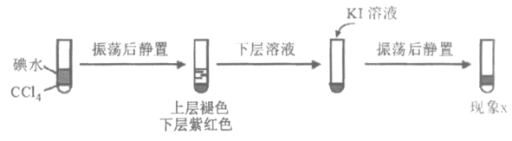
现象x是______________。
(4)针对Ⅱ中溶液未检出I2的原因,提出三种假设:
假设1:溶液中c(H+)较小。小组同学认为此假设不成立,依据是______________。
假设2:O2只氧化了SO2,化学方程式是______________。
假设3:I2不能在此溶液中存在。
(5)设计下列实验,验证了假设3,并继续探究影响氧化还原反应的因素。
i.取Ⅱ中亮黄色溶液,滴入品红,红色褪去。
ii.取Ⅱ中亮黄色溶液,加热,黄色褪去,经品红检验无SO2。加入酸化的AgNO3溶液,产生大量AgI沉淀,长时间静置,沉淀无明显变化。
iii.取Ⅱ中亮黄色溶液,控制一定电压和时间进行电解,结果如下。
电解时间/min | 溶液 | 阳极 | 阴极 |
t1 | 黄色变浅、有少量SO42- | 检出I2,振荡后消失 | H2 |
| 溶液无色、有大量SO42- | 检出I2,振荡后消失 | H2 |
结合化学反应,解释上表中的现象:______________。
(6)综合实验证据说明影响I-被氧化的因素及对应关系______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有100mLMgCl2和AlCl3的混合溶液其中c(Mg2+)=2molL-1,c(Cl-)=7molL-1,要使镁离子转化成Mg(OH)2并使Mg2+和Al3+分离开来,至少需要4molL-1的NaOH溶液
A.140 mL B.120 mL C.200 mL D.80 mL
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下图,可以从不同角度研究含氯物质的性质及其转化关系,图中甲~辛均含氯元素。回答下列问题:

(1)丙的化学式为_______;从组成和性质上分析,丁属于_______(填“酸性”或“碱性”)氧化物。
(2)图中甲、乙、丁、戊中,属于电解质的是__________(填化学式);根据氯元素的化合价判断,乙物质__________。
a 只有氧化性 b 既有氧化性又有还原性
c 只有还原性 d 既能做氧化剂也能做还原剂
(3)电解甲溶液制备己的化学反应为:甲+ H2O→己+H2↑,反应中甲与H2O的物质的量之比是______。
(4)庚是漂白粉的有效成分,用乙制取庚的化学反应方程式为_________。
(5)辛在MnO2催化下受热分解可用于制备一种常见气体,这种气体的化学式是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙两同学分别设计实验,测定CO2与Na2O2反应后的残留物(成分为Na2O2、Na2CO3及少量不溶性杂质)中Na2O2的质量分数。
(1)甲同学设计的实验流程如下:
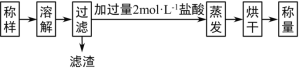
①试样溶解过程中发生反应的化学方程式为_______。
②实验中用12 molL-1盐酸配制2molL-1盐酸500mL,配制过程中用到的仪器有烧杯、玻璃棒、_____、______、_______,定容时俯视刻度线会使所配溶液浓度_____(填“偏高”“偏低”或“无影响”)。
③称取试样5.12 g,得滤渣0.10g,烘干得固体5.85g,则试样中Na2O2的质量分数为___________%(保留1位小数)。
(2)乙同学利用如图所示装置进行实验。

①实验中应选取的试剂是_______________。
a 稀盐酸 b 二氧化锰 c 蒸馏水 d 碳酸钙
②装置的连接顺序应是_______________________(填各接口的字母,连接胶管略)。
查看答案和解析>>
科目: 来源: 题型:
【题目】t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如下表:下列说法正确的是( )
2Z(g),各组分在不同时刻的浓度如下表:下列说法正确的是( )
物质 | X | Y | Z |
初始浓度(mol/L) | 0.1 | 0.2 | 0 |
2min末浓度(mol/L) | 0.08 | a | b |
平衡浓度(mol/L) | 0.05 | 0.05 | 0.1 |
A.平衡时,X的转化率为20%
B.t℃时,2min末Y与Z的物质的量浓度:a=0.06mol/L,b=0.4mol/L
C.增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动
D.前2min内,用Y的变化量表示的平均反应速率v(Y)=0.03mol/(L·min)
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋约占地球表面积的71%,海水资源的利用前景广阔,从海水中提取镁的主要步骤如图所示,下列说法正确的是
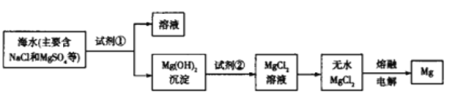
A.工业上利用NaOH溶液使Mg2+转化为Mg(OH)2
B.与Mg同周期的金属都可以采用电解熔融的无水氯化物来制备
C.试剂②可以选用盐酸
D.工业上也可以将Mg(OH)2煅烧分解为MgO,通过电解熔融MgO制取Mg
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图。

(1)O点导电能力为零的理由: 。
(2)a、b、c三点酸性由大到小的顺序为 。
(3)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选 。
A.加热
B.加很稀的NaOH溶液
C.加固体KOH
D.加水
E.加固体CH3COONa
F.加Zn粒
(4)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是 。
A.c(H+) B.H+个数
C.CH3COOH分子数 D.c(H+)/c(CH3COOH)
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温恒容条件下,发生反应:3A(g)+B(g)![]() 2C(g)△H=-QkJ/mol在3个密闭容器中,按下列方式投入反应物:
2C(g)△H=-QkJ/mol在3个密闭容器中,按下列方式投入反应物:
Ⅰ.3molA,1molB;Ⅱ.6molA,2molB;Ⅲ.4molC
则在保持恒温恒容反应达到平衡时,下列选项正确的是( )
A.容器Ⅰ与容器Ⅱ中,C的浓度2cⅠ<cⅡ,平衡常数KⅠ=KⅡ,转化率aⅠ>aⅡ
B.容器Ⅰ与容器Ⅲ中,B的体积分数vⅠ%>vⅢ%,反应的能量变化2QⅠ=QⅢ,平衡常数KⅠ2=![]()
C.容器Ⅱ与容器Ⅲ为等效平衡,B的体积分数VⅡ%=VⅢ%,转化率aⅢ+aⅡ=1,反应的能量变化QⅡ+QⅢ=Q
D.容器Ⅰ容器Ⅱ容器Ⅲ中,平衡常数关系为:KⅠ2=KⅡ=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com