
科目: 来源: 题型:
【题目】有关晶体的结构如下图所示,下列说法中不正确的是( )
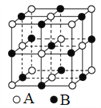

A. 在图1晶体中,距粒子B最近且等距的粒子A有6个
B. 在CO2晶体中,每个晶胞平均占有4个原子
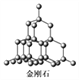
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
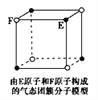
D. 该气态团簇分子的分子式为E4F4
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E均为短周期元素,原子序数依次增大,请根据表中信息回答下列问题:
元素 | 元素性质或结构 |
A | 最外层电子数是其内层电子数的2倍 |
B | B元素的单质在空气中含量最多 |
C | C元素在地壳中含量最多 |
D | D元素在同周期中金属性最强 |
E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(1)E在元素周期表中的位置___.
(2)B最简单气态氢化物的电子式___,属于____化合物(填“离子”或“共价”);D的最高价氧化物的水化物电子式___,所含化学键类型:___.
(3)B、C、D、E简单离子半径由大到小顺序为: ____(填离子符号).
(4)用电子式表示E的氢化物的形成过程_____.
(5)由A、B、C与氢元素组成的一种常见酸式盐与过量D的最高价氧化物的水化物反应的离子方程式:___.
查看答案和解析>>
科目: 来源: 题型:
【题目】关于氢键,下列说法正确的是( )
A. 每一个水分子内含有两个氢键
B. 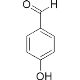 的熔沸点明显高于
的熔沸点明显高于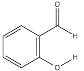 ,对羟基苯甲醛分子间存在氢键,而邻羟基苯甲醛存在分子内氢键。
,对羟基苯甲醛分子间存在氢键,而邻羟基苯甲醛存在分子内氢键。
C. H2O是一种非常稳定的化合物,这是由于氢键所致
D. SO2易溶于水,重要的原因之一是由于SO2与H2O之间能形成氢键
查看答案和解析>>
科目: 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
按下列合成步骤回答问题:

苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/°C | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了___________气体,发生的反应方程式______________________________。采用分液漏斗滴加溴的方式,这样的好处是_______________;c的作用_________________; 冷凝水的方向是________________(填写“上进下出”或者“下进上出”);
(2)液溴滴完后,经过下列步骤分离提纯:
(a)向a中加入10mL水,然后通过过滤除去未反应的铁屑;
(b)滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是_________;
(c)向分出的粗溴苯中加入少量的无水硫酸镁,静置、过滤。加入硫酸镁的目的是_____;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为________,要进一步提纯,下列操作中必须的是________(填入正确选项前的字母);
a.重结晶 b.过滤 c.蒸馏 d.萃取
(4)在该实验中,a的容积最适合的是___(填入正确选项前的字母)。
a.25mL b.50mL c.250mL d.500mL
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于Na2CO3 和NaHCO3的叙述不正确的是
A.在相同情况下,Na2CO3 比NaHCO3易溶于水
B.温度相同,浓度相同Na2CO3 溶液的碱性比NaHCO3溶液碱性强
C.可用相同的离子方程式表示Na2CO3 和NaHCO3分别与Ca(OH)2溶液的反应
D.等质量的Na2CO3 和NaHCO3分别与足量的盐酸溶液反应,后者放出的CO2多
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定质量的Mg和Al的混合物投入![]() 的稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如图所示。则下列说法正确的是
的稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如图所示。则下列说法正确的是![]()
![]()
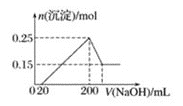
A.Mg、Al的混合物与![]() 的稀硫酸恰好完全反应
的稀硫酸恰好完全反应
B.生成![]() 的体积为
的体积为![]()
C.当加入20mL氢氧化钠溶液时,溶液中的溶质只有硫酸镁和硫酸铝
D.NaOH溶液的物质的量浓度为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】己烯雌酚是非甾体雄激素物质,可通过以下方法合成:
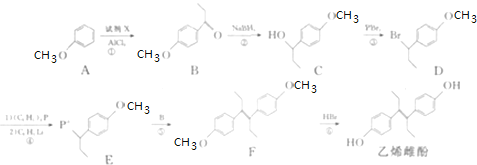
![]() 化合物B中的含氧官能团为 ______
化合物B中的含氧官能团为 ______ ![]() 填名称
填名称![]() ;
;
![]() 反应
反应![]() 中加入的试剂X的分子式为
中加入的试剂X的分子式为![]() ,X的结构简式为 ______ ;
,X的结构简式为 ______ ;
![]() 上述反应
上述反应![]() 、
、![]() 、
、![]() 、
、![]() 中,属于取代反应的是 ______
中,属于取代反应的是 ______ ![]() 填序号
填序号![]() ;
;
![]() 的一种同分异构体满足下列条件:
的一种同分异构体满足下列条件:
![]() 能发生银镜反应,其水解产物之一能与
能发生银镜反应,其水解产物之一能与![]() 溶液发生显色反应;
溶液发生显色反应;
![]() 核磁共振氢谱有4个峰.该同分异构体的结构简式为 ______
核磁共振氢谱有4个峰.该同分异构体的结构简式为 ______ ![]() 任写一种
任写一种![]() .
.
![]() 化合物
化合物![]() 可由
可由![]() 经五步反应合成:
经五步反应合成:
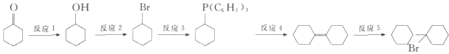
反应3的试剂为 ______ ![]()
![]() ;
;
反应2的化学方程为 ______ ;
反应5的化学方程式为: ______ .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是( )
A.实验室制氢气,为了加快反应速率,可向稀 H2SO4 中滴加少量 Cu(NO3)2 溶液
B.N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,仅升高温度,达平衡时氢气转化率增大
2NH3(g) ΔH<0,仅升高温度,达平衡时氢气转化率增大
C.吸热反应“TiO2(s)+2Cl2(g) =TiCl4(g)+O2(g)”一定条件下可自发进行,则该反应ΔS<0
D.在稀AgNO3溶液中加入过量 NaCl溶液,产生白色沉淀,再加入少量 Na2S溶液,出现黑色沉淀,则加入Na2S溶液后 c(Ag+) 更小了
查看答案和解析>>
科目: 来源: 题型:
【题目】研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+![]() O2(g)=CO2(g) ΔH=-280.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-280.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-290.0 kJ·mol-1
此反应的热化学方程式是_______。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-akJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-bkJ·mol-1(b>0)
若用标准状况下22.4L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为_mol,放出的热量为___kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-540 kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1molCH4还原NO2至N2,整个过程中放出的热量为860 kJ,则ΔH2=__。
查看答案和解析>>
科目: 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,如下图是从该矿渣中回收NiSO4的工艺路线:
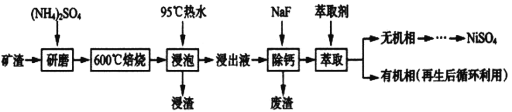
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4,NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第IVA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是_______________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为_________________________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有___________________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将:Fe3+还原为Fe2+,所需SnC12的物质的量不少于Fe3+物质的量的_____倍:除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为_________________________________________。
(4)“浸出液”中c(Ca2+)=1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-)=___mol· L-1。[已知KSP(CaF2)=4.0×10-11]
(5)已知正十二烷可用作该工艺的萃取剂。用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷。已知电解总反应为:2C6H13COONa+2CH3OH![]() C12H26+2CO2↑+H2↑+2CH3ONa,则阳极的电极反应式为______________________________________
C12H26+2CO2↑+H2↑+2CH3ONa,则阳极的电极反应式为______________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com