
科目: 来源: 题型:
【题目】A、B、C、D、E、W为六种前四周期元素,它们的原子序数依次增大. A 与 D 同主族,可形成 DA 型离子化合物,B与C同周期且相邻,C与E同主族,E2-与 Ar 原子具有相同的电子层结构,W 的合金用量最大、用途最广.请回答下列问题:
(1)D 在元素周期表中的位置___________.
(2)A 分别与 C、E 形成最简单化合物中沸点较高的是________(填化学式),原因是____________.
(3)A、C、D三种元素形成的物质中含有的化学键类型______,灼热的碳能与 B 的最高价氧化物对应水化物的浓溶液反应,化学反应方程式为_____________.
(4)向盛有A2C2 溶液的试管中加入几滴酸化的WEC4 溶液,溶液变成棕黄色,发生反应的离子方程式为____________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是_______;生成沉淀的原因是____________(用平衡移动原理解释).
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示装置是化学实验室的常用装置,它有多种用途.以下各项用途和操作都正确的是
(已知:2H2S+SO2=3S+2H2O)
A.干燥CO2:瓶内放一定体积浓硫酸,由a进气
B.用于收集O2:瓶内充满水,由b进气
C.提供少量CO:瓶内充满CO,b接进水管
D.用做H2S和SO2反应的装置:由a通入H2S,b通入SO2
查看答案和解析>>
科目: 来源: 题型:
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N | C—H |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 | 414 |
则该反应的ΔH=_________kJ·mol-1。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) CH3OH(g) ΔH <0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
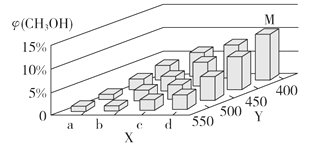
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为_________。
②X轴上a点的数值比b点_________ (填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是________________________________。
(3)工业上可采用CH3OH CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通
CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通
过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为_________(填A、B)。
下图为计算机模拟的各步反应的能量变化示意图。
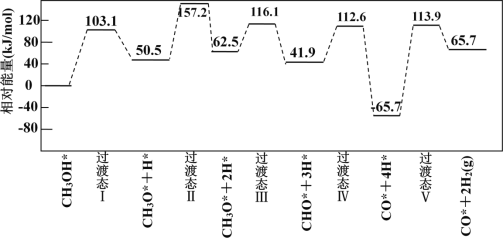
该历程中,放热最多的步骤的化学方程式为______________________________________________。
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol·L-1,则Ksp(PbI2)=_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外小组在实验室制备氨气,并进行有关氨气的性质探究.
![]() 该小组同学加热生石灰与氯化铵的混合物制取干燥的氨气.
该小组同学加热生石灰与氯化铵的混合物制取干燥的氨气.
![]() 应该选用的仪器及装置有
应该选用的仪器及装置有![]() 填字母
填字母![]() ______ .
______ .
![]() 生石灰与氯化铵反应生成氨气的化学方程式为 ______ .
生石灰与氯化铵反应生成氨气的化学方程式为 ______ .
![]() 该小组同学设计如图所示装置探究氨气的还原性.
该小组同学设计如图所示装置探究氨气的还原性.

在上述过程会同时发生多个反应,写出其中属于置换反应的化学方程式 ______ ![]() 若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为 ______ .
若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为 ______ .
![]() 该小组同学以氨气和二氧化碳为原料制备碳酸氢铵.
该小组同学以氨气和二氧化碳为原料制备碳酸氢铵.
![]() 甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳.合适的方案是 ______
甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳.合适的方案是 ______ ![]() 填“甲”或“乙”
填“甲”或“乙”![]() ,原因是 ______ .
,原因是 ______ .
![]() 检验产物中有
检验产物中有![]() 的方法为 ______ .
的方法为 ______ .
查看答案和解析>>
科目: 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.铅蓄电池是典型的可充型电池,电池总反应为:Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O。
2PbSO4+2H2O。
请回答下列问题:
(1)放电时,负极材料是___;电解液中H2SO4的浓度将变___(选“变大”“变小”或“不变”);
(2)充电时,阳极的电极反应式是___。
II.如图是一个化学过程的示意图。

(1)图中甲池是___装置(填“电解池”或“原电池”),其中K+移向___极(选“正”或“负”)
(2)乙池中石墨电极A上发生的电极反应式:___。
(3)若丙内为足量NaCl溶液,当甲池内通入11.2LO2(标准状况下),则丙池中产生的气体的体积为____L(标准状况下)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:

(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应aA(g)+bB(g)![]() cC(g)+dD(g) ΔH,反应特点与对应的图像的说法中不正确的是( )
cC(g)+dD(g) ΔH,反应特点与对应的图像的说法中不正确的是( )
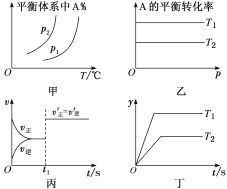
A.图甲中,若p1>p2,则在较低温度下有利于该反应自发进行
B.图乙中,若T2>T1,则ΔH<0且a+b=c+d
C.图丙中,t1时刻改变的条件一定是使用了催化剂
D.图丁中,若ΔH<0,则纵坐标不可能表示的是反应物的转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生反应2HI(g)+Cl2(g)![]() 2HCl(g) +I2(s)。下列事实不能说明该反应达到平衡状态的是
2HCl(g) +I2(s)。下列事实不能说明该反应达到平衡状态的是
A. 断裂1mol Cl-Cl键的同时形成2molH-Cl键
B. 容器内气体密度不再改变
C. 容器内气体颜色不再改变
D. 容器内气体压强不再改变
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下的定容密闭容器中,发生反应:2NO2(g)![]() N2O4(g)。下列说法正确的是
N2O4(g)。下列说法正确的是
A. 混合气体平均相对分子质量不变时,反应达到平衡状态
B. 达到平衡后,两种物质的浓度之比为2:1
C. 升高温度,平衡状态不改变
D. 若平衡后压强是开始的0.8倍,则转化率为20%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com