
科目: 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2H2(g)+O2(g)=2H2O(l)△H=﹣483.6 kJmol﹣1,则氢气的燃烧热为483.6 kJmol﹣1
B. 在一定温度和压强下,将0.5mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放出热量19.3 kJ,则其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=﹣19.3kJ/mol
2NH3(g) △H=﹣19.3kJ/mol
C. 已知2C(s)+2O2(g)=2CO2(g)△H1 2C(s)+O2(g)=2CO(g)△H2 则△H1>△H2
D. 已知Ni(CO)4(s)=Ni(s)+4CO(g) △H=Q kJmol﹣1,则Ni(s)+4CO(g)=Ni(CO)4(s) △H=﹣Q kJmol﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,分别取浓度不同、体积均为20.00mL的3种HCl溶液,分别滴入浓度为1.000mol·L-1,0.1000mol·L-1和0.01000mol·L-1的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00mL前后出现突跃。下列说法不正确的是
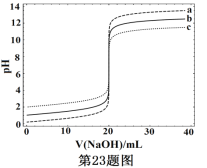
A. 3种HCl溶液的c(HCl):最大的是最小的100倍
B. 曲线a、b、c对应的c(NaOH):a>b>c
C. 当V(NaOH)=20.00mL时,3个体系中均满足:c(Na+)=c(Cl-)
D. 当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快 ②NO(g)+NOBr2(g)
NOBr2(g) 快 ②NO(g)+NOBr2(g)![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 正反应的活化能比逆反应的活化能小a kJ·mol-1
D. 增大Br2(g)浓度能增大活化分子百分数, 加快反应速率
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组有机物中,无论以何种比例混合,只要二者的物质的量之和不变,完全燃烧时消耗的氧气及生成的水的物质的量也不变的是
A.C2H2和C6H6
B.C2H6和C2H5OH
C.C2H4和C2H6O
D.C6H6和C7H6O2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列大小关系正确的是
A.熔点:己烷>2-甲基丁烷>戊烷>丁烷
B.含氢量:甲烷>乙烷>乙烯>乙炔>苯
C.密度:苯>H2O>CCl4
D.相同物质的量物质完全燃烧耗氧量:己烷>环己烷>苯
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH +3O2![]() 2CO2+ 4H2O。下列说法不正确的是
2CO2+ 4H2O。下列说法不正确的是
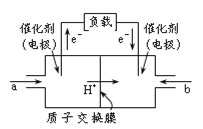
A.左电极为电池的负极,a处通入的物质是甲醇
B.正极反应式为:O2+ 2H2O + 4e-= 4OH-
C.负极反应式为:CH3OH + H2O-6e- = CO2+ 6H+
D.该电池提供1mole-,消耗氧气0.25mol
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)△H
CH3OH(g)△H
(1)该反应的平衡常数表达式为_______;
(2)如表所列数据是反应在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应的△H______0(填“>”、“=”或“<”);
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10s后达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为____,用H2表示反应速率为_____,此时的温度为______;
(3)要提高CO的转化率,可以采取的措施是______;
a.升温 b.加入催化剂 c.增加CO的浓度
d.恒容充入H2 e.恒压充入惰性气体 f.分离出甲醇
查看答案和解析>>
科目: 来源: 题型:
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中钨主要存在于黑钨矿中,其主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、As的化合物。由黑钨矿冶炼钨的工艺流程如下:
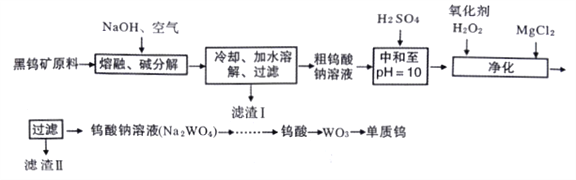
已知:
①滤渣I的主要成份是Fe2O3、MnO2。
②上述流程中,钨的化合价只有在最后一步发生改变。
③常温下钨酸难溶于水。
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为____,请写出MnWO4在熔融条件下发生碱分解反应生成Fe2O3的化学方程式__________。
(2)上述流程中向粗钨酸钠溶液中加硫酸中和至pH=10后,溶液中的杂质阴离子确SiO32-、HAsO32-、HAsO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为____,滤渣Ⅱ的主要成分是____。
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。下图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则:
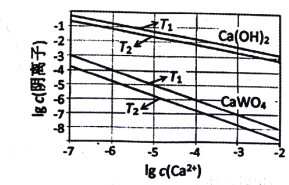
①T1 _____T2(填“>”或“<”)T1时Ksp(CaWO4)=____。
②将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A. 正极反应为AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目: 来源: 题型:
【题目】请把下列现象中浓硫酸表现出来的性质写填在对应的空白处:
(1)把浓硫酸滴在白纸上,白纸变黑,则浓硫酸表现___(填“脱水性”或“氧化性”);
(2)盛有浓硫酸的烧杯敞口放置一段时间,质量增加,则浓硫酸表现出___(填“吸水性”或“脱水性”);
(3)浓硫酸与碳共热时发生反应2H2SO4(浓)+C![]() CO2↑+2SO2↑+2H2O,在该反应中,浓硫酸表现出___(填“酸性”或“强氧化性”)。
CO2↑+2SO2↑+2H2O,在该反应中,浓硫酸表现出___(填“酸性”或“强氧化性”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com