
科目: 来源: 题型:
【题目】水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用![]() 标注。下列说法正确的是( )
标注。下列说法正确的是( )
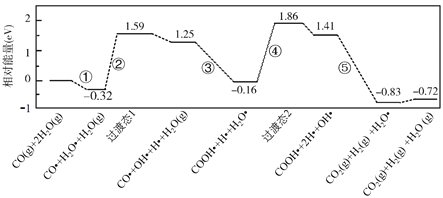
A.水煤气变换反应的ΔH>0
B.步骤③的化学方程式为:CO●+OH●+H2O(g)=COOH●+H2O●
C.步骤⑤只有非极性键H-H键形成
D.该历程中最大能垒(活化能)E正=1.70eV
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各关系式中能说明反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
A. 3v正(N2)=v正(H2) B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3) D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目: 来源: 题型:
【题目】将5.60 g纯铁粉加入适量稀硫酸中,固体完全溶解。加热条件下向反应液中先加入1.7 g NaNO3固体(已知NO3-在酸性条件下具有强氧化性),再通入448 mL Cl2(标准状况下,假设Cl2不逸出),产物中铁元素全部以Fe3+存在。(要求简要写出计算过程)
(1)被氯气氧化的Fe2+物质的量为________。
(2)NaNO3对应的还原产物中氮元素的化合价是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定该盐酸的浓度在实验室中进行实验。请完成下列填空:
(1)配制100mL0.10mol/LNaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)__→洗涤(并将洗涤液移入容量瓶)→__→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签。
②称量__g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、___、__。
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的标志是___。
②根据上述数据,可计算出该盐酸的浓度约为__(保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的__,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:___。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目: 来源: 题型:
【题目】2018年国际计量大会将摩尔的定义修改为:1摩尔包含6.02214076×1023个基本单元,这一常数被称为阿伏加德罗常数(NA),通常用6.02×1023mol-1表示,新定义于2019年5月20日正式生效。下列说法不正确的是( )
A.标准状况下,22.4L的NH3约含有17×6.02×1023个质子
B.白磷分子(P4)呈正四面体结构,62g白磷中约含有3×6.02×1023个P-P键
C.标准状况下,18gH2O中约含有2×6.02×1023个氢原子
D.由新定义可知,阿伏加德罗常数表达为NA=6.02214076×1023 mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是一个实验室制取氯气并以氯气为原料进行特定反应的装置:
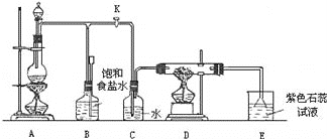
(1)A是氯气发生装置,其中反应的化学方程式为_____。
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,连接上E装置。Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。试写出D中反应的化学方程式:_____。装置C的作用是_____。
(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是_____。
(4)若将E处烧杯中溶液改为澄清石灰水,反应过程现象为_____(选填标号)。
A.有白色沉淀生成 B.无现象 C.先生成白色沉淀,而后白色沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是_____,B的作用是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
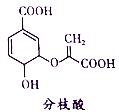
A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目: 来源: 题型:
【题目】四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4∶1,其d轨道中的电子数与最外层电子数之比为5∶1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是________、________;杂化轨道分别是________、________;a分子的立体结构是________。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是________晶体、________晶体。
(3)Y与Z比较,电负性较大的是________,W2+离子的核外电子排布式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com