
【题目】水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用![]() 标注。下列说法正确的是( )
标注。下列说法正确的是( )
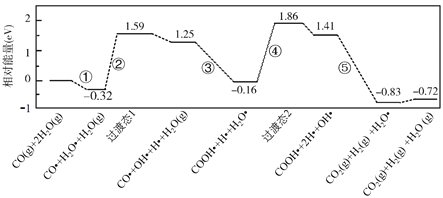
A.水煤气变换反应的ΔH>0
B.步骤③的化学方程式为:CO●+OH●+H2O(g)=COOH●+H2O●
C.步骤⑤只有非极性键H-H键形成
D.该历程中最大能垒(活化能)E正=1.70eV
【答案】B
【解析】
图象分析可知水煤气的生成过程经过了过渡态1和过渡态2,最后生成产物的能量低于反应物,正反应进行的方向需要吸收能量,结合图此分析判断,该历程中最大能垒(活化能)E正,得到反应的化学方程式。
A.图象分析可知水煤气的生成过程经过了过渡态1和过渡态2,最后生成产物的能量低于反应物,反应的焓变ΔH小于0,故A错误;
B.结合此图分析判断,③是发生的过渡反应:CO●+OH●+H2O(g)=COOH●+H2O●,故B正确;
C.步骤⑤中H-O键原反应物中已经存在,则形成的化学键包括极性键C=O,非极性键H-H键形成,故C错误;
D.该历程中最大能垒(活化能)E正=1.86eV-(-0.16eV)=2.02eV,故D错误;
故答案为B。


科目:高中化学 来源: 题型:
【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两种金属组成的合金A,在合适的条件下可按下图进行反应(部分产物和水省略),已知F为红褐色沉淀,请回答:
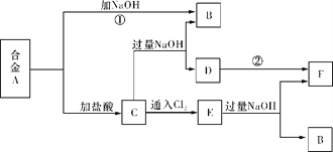
(1)溶液C的溶质主要是____________________(填化学式)。
(2)写出反应②的化学方程式_______________________________________________。描述D变F的实验现象_______________________________________________。
(3)写出反应C→E的离子方程式________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定该盐酸的浓度在实验室中进行实验。请完成下列填空:
(1)配制100mL0.10mol/LNaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)__→洗涤(并将洗涤液移入容量瓶)→__→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签。
②称量__g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、___、__。
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的标志是___。
②根据上述数据,可计算出该盐酸的浓度约为__(保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的__,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:___。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红色固体X由两种元素组成,为探究其组成和性质,设计了如下实验:

请回答:
(1)气体Y的一种同素异形体的分子式是______,红褐色沉淀的化学式______。
(2)X在隔绝空气条件下受高温分解为Y和Z的化学方程式____________。
(3)取黄色溶液W滴加在淀粉KI试纸上,试纸变蓝色,用离子方程式表示试纸变蓝的原因____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法不正确的是( )
A.C60与金刚石互为同素异形体
B.氢键属于化学键
C.金属元素和非金属元素形成的化合物在熔融状态下一定能导电
D.“NH4Cl”的意义是指氯化铵晶体由NH4+和Cl-构成,阴、阳离子个数比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某结晶水合物含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的三种离子,实验小组为确定其化学式做了如下实验:
中的三种离子,实验小组为确定其化学式做了如下实验:
![]() 准确称取
准确称取![]() 样品,配制成
样品,配制成![]() 溶液X。
溶液X。
![]() 取
取![]() 溶液X,加入足量盐酸,无明显现象;再加足量
溶液X,加入足量盐酸,无明显现象;再加足量![]() 溶液,产生白色沉淀;将沉淀过滤、洗涤、干燥至恒重,得白色固体
溶液,产生白色沉淀;将沉淀过滤、洗涤、干燥至恒重,得白色固体![]() 。
。
![]() 取
取![]() 溶液X,加入适量稀硫酸酸化后,用
溶液X,加入适量稀硫酸酸化后,用![]() 溶液滴定至终点,重复滴定三次,测得消耗
溶液滴定至终点,重复滴定三次,测得消耗![]() 溶液体积的平均值为
溶液体积的平均值为![]() 。
。
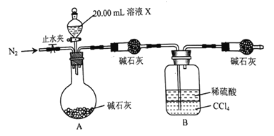
![]() 设计如图所示的装置,取
设计如图所示的装置,取![]() 溶液Ⅹ进行实验,实验前后B装置增重
溶液Ⅹ进行实验,实验前后B装置增重![]() 。
。
![]() 取少量溶液X,滴加
取少量溶液X,滴加![]() 溶液无明显现象,再向其中滴加
溶液无明显现象,再向其中滴加![]() 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
回答下列问题;
![]() 完成实验
完成实验![]() 所需要的玻璃仪器有;烧杯、玻璃棒、量筒、____________。
所需要的玻璃仪器有;烧杯、玻璃棒、量筒、____________。
![]() 实验
实验![]() 达到滴定终点的现象是_____________________。
达到滴定终点的现象是_____________________。
![]() 实验
实验![]() 的反应结束后,打开止水夹通入
的反应结束后,打开止水夹通入![]() 的作用是________________。
的作用是________________。
![]() 根据以上实验数据计算该结晶水合物的化学式为______________。
根据以上实验数据计算该结晶水合物的化学式为______________。
![]() 某同学查阅资料发现 AgSCN为白色难溶物,
某同学查阅资料发现 AgSCN为白色难溶物,![]() 可以氧化
可以氧化![]() 和
和![]() 。为探究
。为探究![]() 和
和![]() 的还原性强弱,该同学设计了如图实验装置并进行下列实验。
的还原性强弱,该同学设计了如图实验装置并进行下列实验。
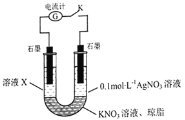
先断开电键K,向溶液X中滴加![]() 溶液,无明显现象,说明_____________;闭合电键K后,若观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是_____________,溶液变红的原因是___________
溶液,无明显现象,说明_____________;闭合电键K后,若观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是_____________,溶液变红的原因是___________![]() 用离子方程式表示
用离子方程式表示![]() ,该实验设计的优点是_______________。
,该实验设计的优点是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物的反应机理,对于消除其对环境的污染有重要意义。请回答下列与氮元素有关的问题:
(1)亚硝酸氯(结构式为Cl-N=O)是有机合成中的重要试剂。它可由Cl2和NO在通常条件下反应制得,反应方程式为2NO(g)+Cl2(g) ![]() 2ClNO(g)。已知几种化学的键能数据如下表所示:
2ClNO(g)。已知几种化学的键能数据如下表所示:

当Cl2与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为____kJ.
(2)在一个恒容密闭容器中充入2molNO(g)和1 mol Cl2(g)发生(1)中反应,在温度分别为T1、T2时测得NO的物质的量(单位:mol)与时间的关系如下表所示
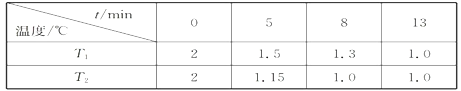
①T1________T2(填“>“”<”或”=”)。
②温度为T2℃时,在相同容器中,充入4molNO(g)和2mo1Cl2(g),则NO的平衡转化率___________50%(填“大于”、“等于”或“小于”)
③温度为T2℃时,起始时容器内的强为p0,则该反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3-),其工作原理如图所示
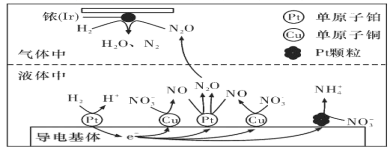
①Ir表面发生反应的方程式为_________________________________________________。
②若导电基体上的Pt颗粒增多,造成的后果是___________________________________。
II:利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来精炼银,装置如图所示
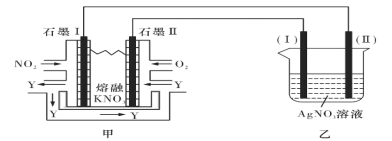
请回答下列问题:
(4)①甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用,则石墨II负极发生的电极反应式为____________________________________________。
②若用10A的电流电解60min,已知该电解池的电解效率为80.4%,则乙中阴极得到____g质量的Ag。(保留小数点后一位。通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率。法拉第常数为96500C/mol)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com