
【题目】某结晶水合物含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的三种离子,实验小组为确定其化学式做了如下实验:
中的三种离子,实验小组为确定其化学式做了如下实验:
![]() 准确称取
准确称取![]() 样品,配制成
样品,配制成![]() 溶液X。
溶液X。
![]() 取
取![]() 溶液X,加入足量盐酸,无明显现象;再加足量
溶液X,加入足量盐酸,无明显现象;再加足量![]() 溶液,产生白色沉淀;将沉淀过滤、洗涤、干燥至恒重,得白色固体
溶液,产生白色沉淀;将沉淀过滤、洗涤、干燥至恒重,得白色固体![]() 。
。
![]() 取
取![]() 溶液X,加入适量稀硫酸酸化后,用
溶液X,加入适量稀硫酸酸化后,用![]() 溶液滴定至终点,重复滴定三次,测得消耗
溶液滴定至终点,重复滴定三次,测得消耗![]() 溶液体积的平均值为
溶液体积的平均值为![]() 。
。
![]() 设计如图所示的装置,取
设计如图所示的装置,取![]() 溶液Ⅹ进行实验,实验前后B装置增重
溶液Ⅹ进行实验,实验前后B装置增重![]() 。
。
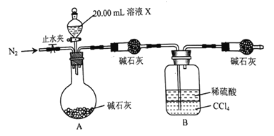
![]() 取少量溶液X,滴加
取少量溶液X,滴加![]() 溶液无明显现象,再向其中滴加
溶液无明显现象,再向其中滴加![]() 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
回答下列问题;
![]() 完成实验
完成实验![]() 所需要的玻璃仪器有;烧杯、玻璃棒、量筒、____________。
所需要的玻璃仪器有;烧杯、玻璃棒、量筒、____________。
![]() 实验
实验![]() 达到滴定终点的现象是_____________________。
达到滴定终点的现象是_____________________。
![]() 实验
实验![]() 的反应结束后,打开止水夹通入
的反应结束后,打开止水夹通入![]() 的作用是________________。
的作用是________________。
![]() 根据以上实验数据计算该结晶水合物的化学式为______________。
根据以上实验数据计算该结晶水合物的化学式为______________。
![]() 某同学查阅资料发现 AgSCN为白色难溶物,
某同学查阅资料发现 AgSCN为白色难溶物,![]() 可以氧化
可以氧化![]() 和
和![]() 。为探究
。为探究![]() 和
和![]() 的还原性强弱,该同学设计了如图实验装置并进行下列实验。
的还原性强弱,该同学设计了如图实验装置并进行下列实验。
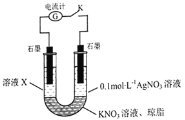
先断开电键K,向溶液X中滴加![]() 溶液,无明显现象,说明_____________;闭合电键K后,若观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是_____________,溶液变红的原因是___________
溶液,无明显现象,说明_____________;闭合电键K后,若观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是_____________,溶液变红的原因是___________![]() 用离子方程式表示
用离子方程式表示![]() ,该实验设计的优点是_______________。
,该实验设计的优点是_______________。
【答案】.![]() 容量瓶、胶头滴管 当最后一滴
容量瓶、胶头滴管 当最后一滴![]() 标准溶液滴入时,溶液颜色变为浅紫红色,且半分钟内不再发生变化 使锥形瓶中产生的氨气完全进入B装置中被稀硫酸吸收
标准溶液滴入时,溶液颜色变为浅紫红色,且半分钟内不再发生变化 使锥形瓶中产生的氨气完全进入B装置中被稀硫酸吸收 ![]() 溶液中无
溶液中无![]()
![]() 的还原性强于
的还原性强于![]()
![]() 氧化性、还原性离子不直接接触,避免发生沉淀反应而导致离子浓度降低
氧化性、还原性离子不直接接触,避免发生沉淀反应而导致离子浓度降低
【解析】
![]() 配制成
配制成![]() 溶液X需要的玻璃仪器有:烧杯、玻璃棒、量筒、250mL容量瓶、胶头滴管;
溶液X需要的玻璃仪器有:烧杯、玻璃棒、量筒、250mL容量瓶、胶头滴管;
![]() 达到滴定终点的现象是溶液颜色变为浅紫红色;
达到滴定终点的现象是溶液颜色变为浅紫红色;
![]() 打开止水夹通入
打开止水夹通入![]() 的作用是使锥形瓶中产生的氨气完全进入B装置中被稀硫酸吸收;
的作用是使锥形瓶中产生的氨气完全进入B装置中被稀硫酸吸收;
![]() 加入足量盐酸,无明显现象;再加足量
加入足量盐酸,无明显现象;再加足量![]() 溶液,产生白色沉淀硫酸钡
溶液,产生白色沉淀硫酸钡![]() ,硫酸钡的物质的量为
,硫酸钡的物质的量为![]() ,
,![]() ,由
,由![]() 知,
知,![]() ,由
,由![]() 知,实验前后B装置增重
知,实验前后B装置增重![]() ,则生成的氨气的物质的量为
,则生成的氨气的物质的量为![]() ,水的质量为
,水的质量为![]() ,物质的量为
,物质的量为![]() ,从而求出四种微粒的个数比,最后得出化学式;
,从而求出四种微粒的个数比,最后得出化学式;
![]() 溶液遇到
溶液遇到![]() 溶液呈红色,向溶液X中滴加
溶液呈红色,向溶液X中滴加![]() 溶液,无明显现象,说明溶液中无
溶液,无明显现象,说明溶液中无![]() ,观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是
,观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是![]() 的还原性强,生成的Fe3+与SCN-溶液作用使溶液变红,该实验设计的优点是氧化性、还原性离子不直接接触,避免发生沉淀反应而导致离子浓度降低。
的还原性强,生成的Fe3+与SCN-溶液作用使溶液变红,该实验设计的优点是氧化性、还原性离子不直接接触,避免发生沉淀反应而导致离子浓度降低。
![]() 配制成
配制成![]() 溶液X需要的玻璃仪器有:烧杯、玻璃棒、量筒、250mL容量瓶、胶头滴管,故答案为:250mL容量瓶、胶头滴管;
溶液X需要的玻璃仪器有:烧杯、玻璃棒、量筒、250mL容量瓶、胶头滴管,故答案为:250mL容量瓶、胶头滴管;
![]() 达到滴定终点的现象是当最后一滴
达到滴定终点的现象是当最后一滴![]() 标准溶液滴入时,溶液颜色变为浅紫红色,且半分钟内不再发生变化,故答案为:当最后一滴
标准溶液滴入时,溶液颜色变为浅紫红色,且半分钟内不再发生变化,故答案为:当最后一滴![]() 标准溶液滴入时,溶液颜色变为浅紫红色,且半分钟内不再发生变化;
标准溶液滴入时,溶液颜色变为浅紫红色,且半分钟内不再发生变化;
![]() 打开止水夹通入
打开止水夹通入![]() 的作用是使锥形瓶中产生的氨气完全进入B装置中被稀硫酸吸收,故答案为:使锥形瓶中产生的氨气完全进入B装置中被稀硫酸吸收;
的作用是使锥形瓶中产生的氨气完全进入B装置中被稀硫酸吸收,故答案为:使锥形瓶中产生的氨气完全进入B装置中被稀硫酸吸收;
![]() 加入足量盐酸,无明显现象;再加足量
加入足量盐酸,无明显现象;再加足量![]() 溶液,产生白色沉淀硫酸钡
溶液,产生白色沉淀硫酸钡![]() ,硫酸钡的物质的量为
,硫酸钡的物质的量为![]() ,
,![]() ,由
,由![]() 知,
知,![]() ,由
,由![]() 知,实验前后B装置增重
知,实验前后B装置增重![]() ,则生成的氨气的物质的量为
,则生成的氨气的物质的量为![]() ,水的质量为
,水的质量为![]() ,物质的量为
,物质的量为![]() ,则
,则![]() :
:![]() :
:![]() :
:![]() ,所以结晶水合物的化学式为
,所以结晶水合物的化学式为![]() ,故答案为:
,故答案为:![]() ;
;
![]() 溶液遇到
溶液遇到![]() 溶液呈红色,向溶液X中滴加
溶液呈红色,向溶液X中滴加![]() 溶液,无明显现象,说明溶液中无
溶液,无明显现象,说明溶液中无![]() ,观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是
,观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是![]() 的还原性强于SCN-,溶液变红的原因是
的还原性强于SCN-,溶液变红的原因是![]() ,该实验设计的优点是氧化性、还原性离子不直接接触,避免发生沉淀反应而导致离子浓度降低,故答案为:溶液中无
,该实验设计的优点是氧化性、还原性离子不直接接触,避免发生沉淀反应而导致离子浓度降低,故答案为:溶液中无![]() ;
;![]() 的还原性强于
的还原性强于![]() ;
;![]() ;氧化性、还原性离子不直接接触,避免发生沉淀反应而导致离子浓度降低。
;氧化性、还原性离子不直接接触,避免发生沉淀反应而导致离子浓度降低。


科目:高中化学 来源: 题型:
【题目】已知在100 ℃、1.01×105 Pa下,1 mol氢气在氧气中燃烧生成气态水的能量变化如图所示,下列有关说法不正确的是( )
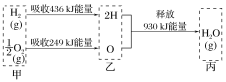
A.1 mol H2O(g)分解为2 mol H与1 mol O时吸收930 kJ热量
B.热化学方程式为:2H2(g)+O2(g)=2H2O(g) ΔH=-490 kJ·mol-1
C.甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙
D.乙→丙的过程中若生成液态水,释放的能量将小于930 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用![]() 标注。下列说法正确的是( )
标注。下列说法正确的是( )
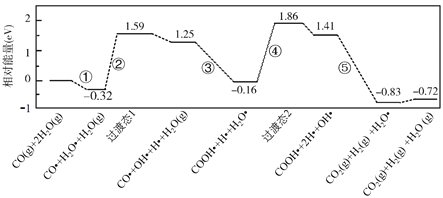
A.水煤气变换反应的ΔH>0
B.步骤③的化学方程式为:CO●+OH●+H2O(g)=COOH●+H2O●
C.步骤⑤只有非极性键H-H键形成
D.该历程中最大能垒(活化能)E正=1.70eV
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质属于同分异构体是___;属于同素异形体是___;属于同位素是___;属于同一种物质是___。(写序号)
①红磷与白磷 ②12C与14C ③干冰与二氧化碳 ④CH4与CH3CH3 ⑤S2与S8 ⑥235U与238U ⑦![]() 与
与![]() ⑧乙醇(
⑧乙醇( )与二甲醚(
)与二甲醚(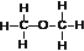 ) ⑨
) ⑨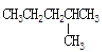 和
和![]() ⑩氰酸铵(NH4CNO)与尿素[CO(NH2)2]
⑩氰酸铵(NH4CNO)与尿素[CO(NH2)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠![]() 是一种工业盐,外观与食盐相似。下面是某学习小组设计的
是一种工业盐,外观与食盐相似。下面是某学习小组设计的![]() 制取实验和纯度检验实验。该小组收集了相关资料:
制取实验和纯度检验实验。该小组收集了相关资料:
![]() 和
和![]() 溶液反应生成
溶液反应生成![]() 和
和![]() 为淡黄色接近白色固体,在水中形成沉淀
为淡黄色接近白色固体,在水中形成沉淀![]()
Ⅰ![]() 亚硝酸钠的制取实验
亚硝酸钠的制取实验
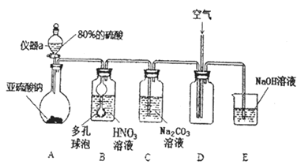
![]() 仪器a的名称为___________,A装置中发生的化学反应方程式为________________。
仪器a的名称为___________,A装置中发生的化学反应方程式为________________。
![]() 装置中多孔球泡的作用_________________________。
装置中多孔球泡的作用_________________________。
![]() 若装置B中逸出的NO与
若装置B中逸出的NO与![]() 气体物质的量之比为
气体物质的量之比为![]() ,则装置B中发生反应的化学方程式为_______。
,则装置B中发生反应的化学方程式为_______。
![]() 实验过程中需控制C装置中溶液
实验过程中需控制C装置中溶液![]() ,否则C中生成的
,否则C中生成的![]() 的产量会下降,理由是_______________。
的产量会下降,理由是_______________。
![]() 请根据题干所给信息设计实验证明C装置中有
请根据题干所给信息设计实验证明C装置中有![]() 产生:__________。
产生:__________。 ![]() 限选用的试剂:稀硝酸、硝酸银溶液、NaOH溶液
限选用的试剂:稀硝酸、硝酸银溶液、NaOH溶液![]()
Ⅱ![]() 亚硝酸钠的纯度检验
亚硝酸钠的纯度检验
已知:![]()
![]()
![]()
![]() span>
span>![]()
![]() 反应结束后C中溶液通过结晶获得
反应结束后C中溶液通过结晶获得![]() 粗产品mg,溶解后稀释至250mL,分别取
粗产品mg,溶解后稀释至250mL,分别取![]() 用
用![]() 的酸性
的酸性![]() 溶液平行滴定三次,平均每次消耗酸性
溶液平行滴定三次,平均每次消耗酸性![]() 溶液的体积为VmL。则粗产品中
溶液的体积为VmL。则粗产品中![]() 的质量分数为_______
的质量分数为_______![]() 用含c、V、m的式子表示
用含c、V、m的式子表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.用广泛pH试纸测得氯水的pH为2.1
B.用玻璃棒蘸取溶液滴在已润湿的pH试纸上测得其pH为12
C.常温下0.1 mol/L的CH3COOH溶液加水稀释,![]() 比值变大
比值变大
D.常温下某溶液中由水电离出的c(H+)为1.0×10-12mol·L-1,一定是碱性溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,A、B、C、D、E物质相互转化关系如图所示(反应条件和部分产物略),其中A、B、C为单质。
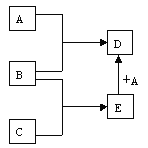
(1)若A为金属,B、C常温下均为气体,D为黑色晶体,E为一种生活中必不可少的物质,则这五种物质的化学式为:A为__,B为__,C为__,D为__,E为__。
(2)A和E在一定条件下反应生成D的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,VIA元素单质与H2反应生成气态H2X的热化学方程式如下:
![]() O2(g) +H2(g) =H2O(g)
O2(g) +H2(g) =H2O(g) ![]() H=-242kJ·mol-1
H=-242kJ·mol-1
S(g)+ H2(g) =H2S(g) ![]() H=-20kJ·mol-1
H=-20kJ·mol-1
Se(g)+H2(g)![]() H2Se(g)
H2Se(g) ![]() H=+81kJ·mol-1
H=+81kJ·mol-1
下列说法正确的是
A. 稳定性:H2O< H2S< H2Se
B. 降温有利于Se与H2反应生成H2Se
C. O2(g)+2H2S(g)=2H2O(g)+2S(g) ![]() H=-444 kJ·mol-1
H=-444 kJ·mol-1
D. 随着核电荷数的增加,VIA族元素单质与H2的化合反应越容易发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据相应的图象(图象编号与答案一一对应),判断下列相关说法正确的是( )
选项 | A | B | C | D |
图像 |
|
|
|
|
反应 | aX(g)+bY(g)cZ(g) | L(s)+aG(g)bR(g) | aA+bBcC | A+2B2C+3D |
操作或条件 | 密闭容器中反应达到平衡,T0时改变某一条件有如图变化所示,则改变的条件一定是加入催化剂 | 反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b | 物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应 | 反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A、B、C是气体,D为固体或液体 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com