
【题目】亚硝酸钠![]() 是一种工业盐,外观与食盐相似。下面是某学习小组设计的
是一种工业盐,外观与食盐相似。下面是某学习小组设计的![]() 制取实验和纯度检验实验。该小组收集了相关资料:
制取实验和纯度检验实验。该小组收集了相关资料:
![]() 和
和![]() 溶液反应生成
溶液反应生成![]() 和
和![]() 为淡黄色接近白色固体,在水中形成沉淀
为淡黄色接近白色固体,在水中形成沉淀![]()
Ⅰ![]() 亚硝酸钠的制取实验
亚硝酸钠的制取实验
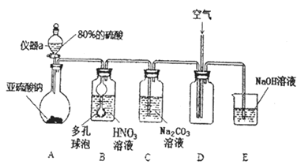
![]() 仪器a的名称为___________,A装置中发生的化学反应方程式为________________。
仪器a的名称为___________,A装置中发生的化学反应方程式为________________。
![]() 装置中多孔球泡的作用_________________________。
装置中多孔球泡的作用_________________________。
![]() 若装置B中逸出的NO与
若装置B中逸出的NO与![]() 气体物质的量之比为
气体物质的量之比为![]() ,则装置B中发生反应的化学方程式为_______。
,则装置B中发生反应的化学方程式为_______。
![]() 实验过程中需控制C装置中溶液
实验过程中需控制C装置中溶液![]() ,否则C中生成的
,否则C中生成的![]() 的产量会下降,理由是_______________。
的产量会下降,理由是_______________。
![]() 请根据题干所给信息设计实验证明C装置中有
请根据题干所给信息设计实验证明C装置中有![]() 产生:__________。
产生:__________。 ![]() 限选用的试剂:稀硝酸、硝酸银溶液、NaOH溶液
限选用的试剂:稀硝酸、硝酸银溶液、NaOH溶液![]()
Ⅱ![]() 亚硝酸钠的纯度检验
亚硝酸钠的纯度检验
已知:![]()
![]()
![]()
![]() span>
span>![]()
![]() 反应结束后C中溶液通过结晶获得
反应结束后C中溶液通过结晶获得![]() 粗产品mg,溶解后稀释至250mL,分别取
粗产品mg,溶解后稀释至250mL,分别取![]() 用
用![]() 的酸性
的酸性![]() 溶液平行滴定三次,平均每次消耗酸性
溶液平行滴定三次,平均每次消耗酸性![]() 溶液的体积为VmL。则粗产品中
溶液的体积为VmL。则粗产品中![]() 的质量分数为_______
的质量分数为_______![]() 用含c、V、m的式子表示
用含c、V、m的式子表示![]() 。
。
【答案】分液漏斗 ![]() 浓
浓![]() 增大气体与溶液的接触面积,让反应充分进行
增大气体与溶液的接触面积,让反应充分进行 ![]() 如果
如果![]() ,亚硝酸盐会转化为硝酸盐和NO气体,使其产量下降 取C中溶液少量于试管中,加足量稀硝酸有气体生成,遇空气变红棕色,则证明C中有
,亚硝酸盐会转化为硝酸盐和NO气体,使其产量下降 取C中溶液少量于试管中,加足量稀硝酸有气体生成,遇空气变红棕色,则证明C中有![]() 生成
生成 ![]() 。
。
【解析】
Ⅰ![]() 仪器a的名称为分液漏斗,A装置中硫酸与亚硫酸钠发生强酸制弱酸的反应生成
仪器a的名称为分液漏斗,A装置中硫酸与亚硫酸钠发生强酸制弱酸的反应生成![]() 。
。
![]() 利用B装置中的多孔球泡可增大
利用B装置中的多孔球泡可增大![]() 气体与溶液的接触面积。
气体与溶液的接触面积。
![]() 装置B中逸出的NO与
装置B中逸出的NO与![]() 的物质的量之比为2:1,假设生成2molNO和
的物质的量之比为2:1,假设生成2molNO和![]() ,共转移
,共转移![]() ,则被氧化的
,则被氧化的![]() 的物质的量为
的物质的量为![]() ,从而得出反应中SO2、NO、NO2物质的量之比为7:4:2,利用此关系可写出反应的方程式。
,从而得出反应中SO2、NO、NO2物质的量之比为7:4:2,利用此关系可写出反应的方程式。
![]() 实验过程中,需控制C中溶液的
实验过程中,需控制C中溶液的![]() ,否则产率会下降,理由是如果
,否则产率会下降,理由是如果![]() ,
,![]() 。
。
(5)取C中溶液少量于试管中,加足量稀硝酸有气体生成,遇空气变红棕色,则证明C中有![]() 生成;
生成;
Ⅱ![]() 设NO2-的物质的量为n
设NO2-的物质的量为n
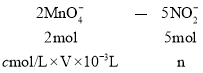
则:n=2.5cV×10-3mol
250mL溶液中所含物质的量![]() ,
,
则粗产品中![]() 的质量分数
的质量分数![]() 。
。
Ⅰ![]() 仪器a的名称为分液漏斗,A装置中硫酸与亚硫酸钠发生强酸制弱酸生成
仪器a的名称为分液漏斗,A装置中硫酸与亚硫酸钠发生强酸制弱酸生成![]() ,化学方程式为:
,化学方程式为:![]()
![]() 浓
浓![]() ,
,
故答案为:分液漏斗;![]()
![]() 浓
浓![]() ;
;
![]() 利用B装置中的多孔球泡可增大
利用B装置中的多孔球泡可增大![]() 气体与溶液的接触面积,让反应充分进行,
气体与溶液的接触面积,让反应充分进行,
故答案为:增大气体与溶液的接触面积,让反应充分进行;
![]() 装置B中逸出的NO与
装置B中逸出的NO与![]() 的物质的量之比为2:1,假设生成2molNO和
的物质的量之比为2:1,假设生成2molNO和![]() ,共转移
,共转移![]() ,则被氧化的
,则被氧化的![]() 的物质的量为
的物质的量为![]() ,故装置B中发生反应的化学方程式为
,故装置B中发生反应的化学方程式为![]() ,
,
故答案为:![]() ;
;
![]() 实验过程中,需控制C中溶液的
实验过程中,需控制C中溶液的![]() ,否则产率会下降,理由是如果
,否则产率会下降,理由是如果![]() ,
,![]() ,亚硝酸盐会转化为硝酸盐和NO气体,
,亚硝酸盐会转化为硝酸盐和NO气体,
故答案为:如果![]() ,亚硝酸盐会转化为硝酸盐和NO气体,使其产量下降;
,亚硝酸盐会转化为硝酸盐和NO气体,使其产量下降;
![]() 已知
已知![]() ,
,![]() 生成;
生成;
故答案为:取C中溶液少量于试管中,加足量稀硝酸有气体生成,遇空气变红棕色,则证明C中有![]() 生成;
生成;
Ⅱ![]() 设NO2-的物质的量为n
设NO2-的物质的量为n
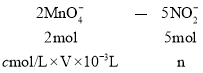
则:n=2.5cV×10-3mol
250mL溶液中所含物质的量![]() ,
,
则粗产品中![]() 的质量分数
的质量分数![]() ,
,
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是( )
A.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g ) ![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1
C.2NO2=O2+2NO ΔH=+116.2 kJ·mol-1
D.S(s)+O2(g)=SO2(g) ΔH=-296.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定该盐酸的浓度在实验室中进行实验。请完成下列填空:
(1)配制100mL0.10mol/LNaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)__→洗涤(并将洗涤液移入容量瓶)→__→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签。
②称量__g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、___、__。
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的标志是___。
②根据上述数据,可计算出该盐酸的浓度约为__(保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的__,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:___。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法不正确的是( )
A.C60与金刚石互为同素异形体
B.氢键属于化学键
C.金属元素和非金属元素形成的化合物在熔融状态下一定能导电
D.“NH4Cl”的意义是指氯化铵晶体由NH4+和Cl-构成,阴、阳离子个数比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二碘(I2O5)可用作氧化剂,除去空气中的一氧化碳,易溶于水形成碘酸,不溶于无水乙醇、乙醚、氯仿和二硫化碳。用下列装置制备五氧化二碘(加热装置及夹持装置省略)。

制备五氧化二碘的步骤如下:
步骤1:I2与KClO3按一定比例加入反应器M中,用硝酸调节pH=1~2,温度控制在80~90℃,搅拌反应1h,使反应完全。
步骤2:然后冷却至室温,析出碘酸氢钾晶体。将过滤得到的晶体加水、加热溶解,并用足量氢氧化钾溶液中和至溶液pH为10。再冷却结晶,过滤得到的晶体于118℃干燥3h,得到碘酸钾产品。
步骤3:将步骤2制得的碘酸钾酸化后得碘酸(HIO3),再将碘酸在干燥空气气流中加热到200℃失水得到五氧化二碘。
(1)五氧化二碘可除去空气中的一氧化碳,反应生成碘单质,该反应中氧化剂与还原剂的物质的量之比为___。
(2)仪器M的名称是___。
(3)步骤1中除了生成碘酸氢钾[KH(IO3)2]外,同时还生成氯化钾和氯气,若n(KCl):n(C12)=5:3,写出该反应的化学方程式:___,该反应中的氧化剂是___(填化学式)。
(4)反扣的漏斗N除了可以防止倒吸,还有一个作用是____,NaOH溶液的作用是___。
(5)步骤2中的主要反应为KH(IO3)2+KOH===2KIO3+H2O,称取0.550g碘酸钾产品(假设杂质不参与反应),将产品放入烧杯中,加蒸馏水溶解,并加入足量酸化的KI溶液,配制成100mL溶液,取10.00mL配制的溶液于锥形瓶中并加入指示剂,然后用0.1mol·L-1 Na2S2O3标准溶液滴定至终点,三次实验平均消耗标准溶液的体积为15.00mL。(已知I2+2Na2S2O3=2NaI+Na2S4O6)
①该滴定选择的指示剂是_____。
②该碘酸钾产品中碘酸钾的质量分数是____%(保留三位有效数字)。
③若装Na2S2O3标准溶液的滴定管没有用Na2S2O3标准溶液润洗,则所测得产品的质量分数___(填“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某结晶水合物含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的三种离子,实验小组为确定其化学式做了如下实验:
中的三种离子,实验小组为确定其化学式做了如下实验:
![]() 准确称取
准确称取![]() 样品,配制成
样品,配制成![]() 溶液X。
溶液X。
![]() 取
取![]() 溶液X,加入足量盐酸,无明显现象;再加足量
溶液X,加入足量盐酸,无明显现象;再加足量![]() 溶液,产生白色沉淀;将沉淀过滤、洗涤、干燥至恒重,得白色固体
溶液,产生白色沉淀;将沉淀过滤、洗涤、干燥至恒重,得白色固体![]() 。
。
![]() 取
取![]() 溶液X,加入适量稀硫酸酸化后,用
溶液X,加入适量稀硫酸酸化后,用![]() 溶液滴定至终点,重复滴定三次,测得消耗
溶液滴定至终点,重复滴定三次,测得消耗![]() 溶液体积的平均值为
溶液体积的平均值为![]() 。
。
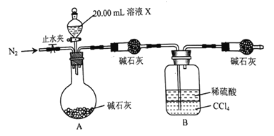
![]() 设计如图所示的装置,取
设计如图所示的装置,取![]() 溶液Ⅹ进行实验,实验前后B装置增重
溶液Ⅹ进行实验,实验前后B装置增重![]() 。
。
![]() 取少量溶液X,滴加
取少量溶液X,滴加![]() 溶液无明显现象,再向其中滴加
溶液无明显现象,再向其中滴加![]() 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
回答下列问题;
![]() 完成实验
完成实验![]() 所需要的玻璃仪器有;烧杯、玻璃棒、量筒、____________。
所需要的玻璃仪器有;烧杯、玻璃棒、量筒、____________。
![]() 实验
实验![]() 达到滴定终点的现象是_____________________。
达到滴定终点的现象是_____________________。
![]() 实验
实验![]() 的反应结束后,打开止水夹通入
的反应结束后,打开止水夹通入![]() 的作用是________________。
的作用是________________。
![]() 根据以上实验数据计算该结晶水合物的化学式为______________。
根据以上实验数据计算该结晶水合物的化学式为______________。
![]() 某同学查阅资料发现 AgSCN为白色难溶物,
某同学查阅资料发现 AgSCN为白色难溶物,![]() 可以氧化
可以氧化![]() 和
和![]() 。为探究
。为探究![]() 和
和![]() 的还原性强弱,该同学设计了如图实验装置并进行下列实验。
的还原性强弱,该同学设计了如图实验装置并进行下列实验。
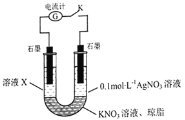
先断开电键K,向溶液X中滴加![]() 溶液,无明显现象,说明_____________;闭合电键K后,若观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是_____________,溶液变红的原因是___________
溶液,无明显现象,说明_____________;闭合电键K后,若观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是_____________,溶液变红的原因是___________![]() 用离子方程式表示
用离子方程式表示![]() ,该实验设计的优点是_______________。
,该实验设计的优点是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向500mLNaOH溶液中投入10.8g的铝,二者恰好完全反应,试计算:
(1)求铝的物质的量___;
(2)参加反应的氢氧化钠的物质的量___和物质的量浓度___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:![]() 时,
时,![]() ;
;![]() ;
;![]() 稀溶液中,
稀溶液中,![]() ;
;![]() ;
;![]() 红磷的化学式为P,白磷的化学式为
红磷的化学式为P,白磷的化学式为![]() ,已知:
,已知:
![]() ;
;![]()
![]() ;
;![]()
下列结论正确的是
A.由于红磷转化为白磷是放热反应,等质量的红磷能量比白磷低
B.稀硫酸和稀氢氧化钠溶液反应的中和热![]()
C.碳的燃烧热大于![]()
D.稀醋酸和稀氢氧化钠溶液反应生成1mol水,放出![]() 热量
热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质:①氯气、②铜片、③碳酸钙、④蔗糖、⑤HCl气体、⑥SO2气体、⑦氨水,能导电的是________________,属于电解质的是_________________。(填编号)
(2)节日焰火利用的是____反应,城市射灯在夜空形成五颜六色的光柱,属于___效应。
(3)①除去铁粉中混用铝粉,选用的试剂为:___________;
②NaHCO3溶液中混有Na2CO3选用的试剂为_____________;
③除去Na2CO3粉末中的NaHCO3,采用的方法__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com