
【题目】向500mLNaOH溶液中投入10.8g的铝,二者恰好完全反应,试计算:
(1)求铝的物质的量___;
(2)参加反应的氢氧化钠的物质的量___和物质的量浓度___。
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:
【题目】室温下,0.1000mol·L-1的盐酸逐滴加入到20.00mL 0.1000mol·L-1的氨水中,溶液的pH和pOH[注:pOH=-lgc(OH-)]与所加盐酸体积的关系如图所示,下列说法中不正确的是( )
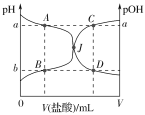
A.图中a+b=14
B.交点J点对应的V(HCl)=20.00 mL
C.点A、B、C、D四点的溶液中均存在如下关系:c(Cl-)-c(NH4+)=c(H+)-c(OH-)
D.若在绝热体系中发生上述反应,图中的交点J向右移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示化合物X的说法错误的是
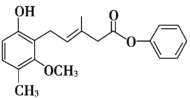
A.X的分子式是C20H20O
B.1 mol该化合物最多可以与3mol NaOH溶液反应
C.X能使酸性高锰酸钾溶液和溴水褪色
D.X在酸性下的两种水解产物都可以与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠![]() 是一种工业盐,外观与食盐相似。下面是某学习小组设计的
是一种工业盐,外观与食盐相似。下面是某学习小组设计的![]() 制取实验和纯度检验实验。该小组收集了相关资料:
制取实验和纯度检验实验。该小组收集了相关资料:
![]() 和
和![]() 溶液反应生成
溶液反应生成![]() 和
和![]() 为淡黄色接近白色固体,在水中形成沉淀
为淡黄色接近白色固体,在水中形成沉淀![]()
Ⅰ![]() 亚硝酸钠的制取实验
亚硝酸钠的制取实验
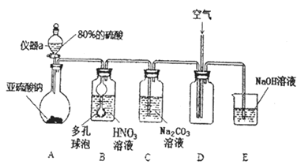
![]() 仪器a的名称为___________,A装置中发生的化学反应方程式为________________。
仪器a的名称为___________,A装置中发生的化学反应方程式为________________。
![]() 装置中多孔球泡的作用_________________________。
装置中多孔球泡的作用_________________________。
![]() 若装置B中逸出的NO与
若装置B中逸出的NO与![]() 气体物质的量之比为
气体物质的量之比为![]() ,则装置B中发生反应的化学方程式为_______。
,则装置B中发生反应的化学方程式为_______。
![]() 实验过程中需控制C装置中溶液
实验过程中需控制C装置中溶液![]() ,否则C中生成的
,否则C中生成的![]() 的产量会下降,理由是_______________。
的产量会下降,理由是_______________。
![]() 请根据题干所给信息设计实验证明C装置中有
请根据题干所给信息设计实验证明C装置中有![]() 产生:__________。
产生:__________。 ![]() 限选用的试剂:稀硝酸、硝酸银溶液、NaOH溶液
限选用的试剂:稀硝酸、硝酸银溶液、NaOH溶液![]()
Ⅱ![]() 亚硝酸钠的纯度检验
亚硝酸钠的纯度检验
已知:![]()
![]()
![]()
![]() span>
span>![]()
![]() 反应结束后C中溶液通过结晶获得
反应结束后C中溶液通过结晶获得![]() 粗产品mg,溶解后稀释至250mL,分别取
粗产品mg,溶解后稀释至250mL,分别取![]() 用
用![]() 的酸性
的酸性![]() 溶液平行滴定三次,平均每次消耗酸性
溶液平行滴定三次,平均每次消耗酸性![]() 溶液的体积为VmL。则粗产品中
溶液的体积为VmL。则粗产品中![]() 的质量分数为_______
的质量分数为_______![]() 用含c、V、m的式子表示
用含c、V、m的式子表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在容积为2 L的密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示。
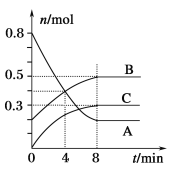
分析图中数据,回答下列问题:
(1)该反应的化学方程式为______________。
(2)反应开始至4 min时,物质A的平均反应速率为____。
(3)4 min时,正反应速率_______(填“>”“<”或“=”,下同)逆反应速率,8 min时,正反应速率________逆反应速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,A、B、C、D、E物质相互转化关系如图所示(反应条件和部分产物略),其中A、B、C为单质。
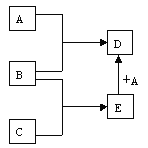
(1)若A为金属,B、C常温下均为气体,D为黑色晶体,E为一种生活中必不可少的物质,则这五种物质的化学式为:A为__,B为__,C为__,D为__,E为__。
(2)A和E在一定条件下反应生成D的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是重要的有机化工原料。以丁烯和乙烯为原料反应生成丙烯的方法被称为“烯烃歧化法”,主要反应为![]()
![]()
![]()
已知相关燃烧热数据:
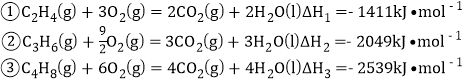
下列说法不正确的是 ( )
A. 消耗等物质的量的原料,反应③的放热最显著
B. 放出相等的热量,反应①产生的![]() 最少
最少
C. “烯烃歧化“反应中消耗![]() ,放热
,放热![]()
D. “烯烃歧化”反应中断键吸收的能量比成键放出的能量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《茉莉花》是首脍炙人口的江苏民歌。乙酸苯甲酯可以从茉莉花中提取,也可用如图路线合成:
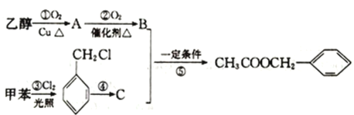
(1)乙酸苯甲酯的分子式为__,C的结构简式为__,B中所含官能团的名称为__,③的反应类型为___。
(2)①的化学方程式为___。
(3)乙酸苯甲酯与NaOH溶液反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习“化学平衡移动原理”后,以你的理解,下列叙述正确的是
A. 对于已达平衡的体系,改变影响化学平衡的条件,不可能出现V正增大,V逆减小的情况。
B. 对2HI![]() H2+I2(g),平衡体系增加压强使颜色变深,可用勒夏特列原理解释。
H2+I2(g),平衡体系增加压强使颜色变深,可用勒夏特列原理解释。
C. 升高温度,一定会使化学平衡发生移动。
D. 在盛有一定量NO2的注射器中,向外拉活塞,其中气体颜色先变浅再变深,甚至比原来深。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com