
【题目】室温下,0.1000mol·L-1的盐酸逐滴加入到20.00mL 0.1000mol·L-1的氨水中,溶液的pH和pOH[注:pOH=-lgc(OH-)]与所加盐酸体积的关系如图所示,下列说法中不正确的是( )
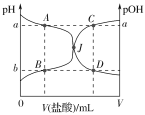
A.图中a+b=14
B.交点J点对应的V(HCl)=20.00 mL
C.点A、B、C、D四点的溶液中均存在如下关系:c(Cl-)-c(NH4+)=c(H+)-c(OH-)
D.若在绝热体系中发生上述反应,图中的交点J向右移
【答案】B
【解析】
A. 图中A点和B点对应的溶质相同,根据a=-lgc(H+),b=-lgc(OH-),c(H+)·c(OH-)=10-14计算可知a+b=-lgc(H+)·c(OH-)=-lg10-14=14,A项正确;
B. 交点J点对应的点pH=7,应该是氨水和氯化铵的混合溶液,V(HCl)<20.00 mL,B项错误;
C. A、B、C、D四点的溶液中均存在电荷守恒,c(Cl-)+c(OH-)=c(NH4+)+c(H+),变式得c(Cl-)-c(NH4+)=c(H+)-c(OH-),C项正确;
D. 中和反应为放热反应,若在绝热体系中发生上述反应,体系的温度升高,水和氨水的电离程度都变大,c(OH-)增大,pOH减小,pH增大,图中的交点J向右移,D项正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是 ( )
CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是 ( )
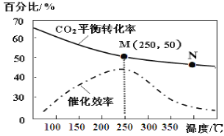
A.M点的正反应速率V正大于N点的逆反应速率V逆
B.若投料比n(H2):n(CO2)=4:1,则图中M点乙烯的体积分数约为5.88%
C.250℃,催化剂对CO2转化率影响最大
D.当温度高于250℃,升高温度,平衡逆向移动导致催化剂的催化效率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究二氧化硫的性质,按如图所示装置进行实验。

请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是__________,反应的化学方程式为_______________。
(2)装置B中的现象是__________________,反应的离子方程式为_________________。
(3)装置C中的现象是____________________,该现象说明二氧化硫具有的性质是________________________。
(4)装置D的目的是探究二氧化硫与品红作用的可逆性,写出实验操作及现象_____________。
(5)尾气可采用__________溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是( )
A.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g ) ![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1
C.2NO2=O2+2NO ΔH=+116.2 kJ·mol-1
D.S(s)+O2(g)=SO2(g) ΔH=-296.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中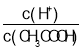 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氯气通入50mL 10.00 mol·L-1的氢氧化钠浓溶液中,加热少许时间后,溶液中只有NaCl、NaClO、NaClO3三种溶质。下列说法正确的是
A.与NaOH反应的氯气物质的量:0.25mol<n(Cl2)<0.5mol
B.若反应中转移的电子为n mol,则0.25<n<0.5
C.溶液中n(Na+):n(Cl-)可能为7:5
D.溶液中n(NaCl):n(NaClO):n(NaClO3)可能为10:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定该盐酸的浓度在实验室中进行实验。请完成下列填空:
(1)配制100mL0.10mol/LNaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)__→洗涤(并将洗涤液移入容量瓶)→__→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签。
②称量__g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、___、__。
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的标志是___。
②根据上述数据,可计算出该盐酸的浓度约为__(保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的__,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:___。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向500mLNaOH溶液中投入10.8g的铝,二者恰好完全反应,试计算:
(1)求铝的物质的量___;
(2)参加反应的氢氧化钠的物质的量___和物质的量浓度___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com