
【题目】某温度时,在容积为2 L的密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示。
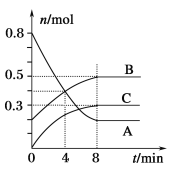
分析图中数据,回答下列问题:
(1)该反应的化学方程式为______________。
(2)反应开始至4 min时,物质A的平均反应速率为____。
(3)4 min时,正反应速率_______(填“>”“<”或“=”,下同)逆反应速率,8 min时,正反应速率________逆反应速率。
【答案】2A(g) B(g) +C(g) 0.15mol/(Lmin) > =
【解析】
(1)由图可知,8min末达到平衡状态,说明该反应为可逆反应,从反应开始到8min末,A的物质的量减少0.6mol、B的物质的量增加0.3mol,C的物质的量增加0.3mol,
因此该反应的化学方程式为2A(g) B(g) +C(g);
(2)反应开始至4min末,A的物质的量减少了0.6mol,v(A)=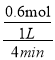 =0.15mol/(Lmin);
=0.15mol/(Lmin);
(3)4min的时候反应物的浓度仍然再继续减少,所以反应向正反应方向进行,即v(正)>v(逆)。8 min时,物质的浓度不再发生变化,反应达到平衡状态,所以v(正)=v(逆)。


科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中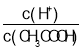 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaSO4在医疗上可作钡餐,高温煅烧BaSO4部分反应如下:
BaSO4(s)+4C(s) BaS(s)+4CO(g) ΔH=+571.2 kJ·mol-1
BaS(s)Ba(s)+S(s) ΔH=+460 kJ·mol-1
已知:2C(s)+O2(g)2CO(g) ΔH=-221 kJ·mol-1
则:Ba(s)+S(s)+2O2(g)BaSO4(s) ΔH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二碘(I2O5)可用作氧化剂,除去空气中的一氧化碳,易溶于水形成碘酸,不溶于无水乙醇、乙醚、氯仿和二硫化碳。用下列装置制备五氧化二碘(加热装置及夹持装置省略)。

制备五氧化二碘的步骤如下:
步骤1:I2与KClO3按一定比例加入反应器M中,用硝酸调节pH=1~2,温度控制在80~90℃,搅拌反应1h,使反应完全。
步骤2:然后冷却至室温,析出碘酸氢钾晶体。将过滤得到的晶体加水、加热溶解,并用足量氢氧化钾溶液中和至溶液pH为10。再冷却结晶,过滤得到的晶体于118℃干燥3h,得到碘酸钾产品。
步骤3:将步骤2制得的碘酸钾酸化后得碘酸(HIO3),再将碘酸在干燥空气气流中加热到200℃失水得到五氧化二碘。
(1)五氧化二碘可除去空气中的一氧化碳,反应生成碘单质,该反应中氧化剂与还原剂的物质的量之比为___。
(2)仪器M的名称是___。
(3)步骤1中除了生成碘酸氢钾[KH(IO3)2]外,同时还生成氯化钾和氯气,若n(KCl):n(C12)=5:3,写出该反应的化学方程式:___,该反应中的氧化剂是___(填化学式)。
(4)反扣的漏斗N除了可以防止倒吸,还有一个作用是____,NaOH溶液的作用是___。
(5)步骤2中的主要反应为KH(IO3)2+KOH===2KIO3+H2O,称取0.550g碘酸钾产品(假设杂质不参与反应),将产品放入烧杯中,加蒸馏水溶解,并加入足量酸化的KI溶液,配制成100mL溶液,取10.00mL配制的溶液于锥形瓶中并加入指示剂,然后用0.1mol·L-1 Na2S2O3标准溶液滴定至终点,三次实验平均消耗标准溶液的体积为15.00mL。(已知I2+2Na2S2O3=2NaI+Na2S4O6)
①该滴定选择的指示剂是_____。
②该碘酸钾产品中碘酸钾的质量分数是____%(保留三位有效数字)。
③若装Na2S2O3标准溶液的滴定管没有用Na2S2O3标准溶液润洗,则所测得产品的质量分数___(填“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列叙述的方法中,能将有机化合物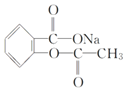 转变为
转变为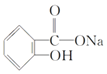 的有( )
的有( )
A.跟足量的NaOH溶液共热后,再通入二氧化碳直至过量
B.把溶液充分加热后,通入足量的二氧化硫
C.与稀H2SO4共热后,加入足量NaOH溶液
D.与稀H2SO4共热后,加入足量NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向500mLNaOH溶液中投入10.8g的铝,二者恰好完全反应,试计算:
(1)求铝的物质的量___;
(2)参加反应的氢氧化钠的物质的量___和物质的量浓度___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。钴酸锂(LiCoO2)电池的工作原理如图所示,其中A极材料是金属锂和石墨的复合材料(石墨作金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过。电池反应式为: LixC6+ Li1-xCoO2![]() C6+LiCoO2。下列说法中正确的是
C6+LiCoO2。下列说法中正确的是
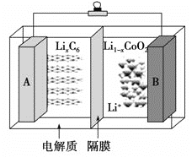
A.充电时Li由B极区域移向A极区域
B.充电时,A为阴极,发生氧化反应C6+xLi++xe-=LixC6
C.放电时,B为正极,电极反应式为Li1-xCoO2+xLi++xe-=LiCoO2
D.废旧钴酸锂(LiCoO2)电池进行“放电处理”使锂进入石墨中而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是
A.新制氯水长时间放置颜色变浅
B.高压比常压更有利于 SO2 转化为 SO3
C.蒸干 AlCl3 溶液无法得到无水 AlCl3
D.滴加少量 CuSO4 溶液可以加快 Zn 与稀 H2SO4 反应的速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com