
【题目】BaSO4在医疗上可作钡餐,高温煅烧BaSO4部分反应如下:
BaSO4(s)+4C(s) BaS(s)+4CO(g) ΔH=+571.2 kJ·mol-1
BaS(s)Ba(s)+S(s) ΔH=+460 kJ·mol-1
已知:2C(s)+O2(g)2CO(g) ΔH=-221 kJ·mol-1
则:Ba(s)+S(s)+2O2(g)BaSO4(s) ΔH=________。
【答案】-1 473.2 kJ·mol-1
【解析】
将已知的热化学方程式依次编号:①BaSO4(s)+4C(s) BaS(s)+4CO(g) ΔH=+571.2 kJ·mol-1,②BaS(s)Ba(s)+S(s) ΔH=+460 kJ·mol-1,③2C(s)+O2(g)2CO(g) ΔH=-221 kJ·mol-1,根据盖斯定律,反应③×2-①-②可得Ba(s)+S(s)+2O2(g)![]() BaSO4(s),据此计算ΔH。
BaSO4(s),据此计算ΔH。
将已知的热化学方程式依次编号:①BaSO4(s)+4C(s) BaS(s)+4CO(g) ΔH=+571.2 kJ·mol-1,②BaS(s)Ba(s)+S(s) ΔH=+460 kJ·mol-1,③2C(s)+O2(g)2CO(g) ΔH=-221 kJ·mol-1,根据盖斯定律,反应③×2-①-②可得Ba(s)+S(s)+2O2(g)![]() BaSO4(s) ΔH=(-221×2-571.2-460) kJ·mol-1=-1 473.2 kJ·mol-1;
BaSO4(s) ΔH=(-221×2-571.2-460) kJ·mol-1=-1 473.2 kJ·mol-1;
故答案为:-1 473.2 kJ·mol-1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某合金只含铝、铁、铜三种元素,取合金![]() ,加入到含
,加入到含![]() 稀硝酸的溶液中,恰好完全反应,放出无色气体
稀硝酸的溶液中,恰好完全反应,放出无色气体![]() 标准状况下
标准状况下![]() 。将反应后的溶液分成2等份,向一份溶液中滴加
。将反应后的溶液分成2等份,向一份溶液中滴加![]() ,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体
,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体![]() ,减轻了
,减轻了![]() ,再加入到过量的
,再加入到过量的![]() 溶液中,剩余不溶物
溶液中,剩余不溶物![]() 。下列说法不正确的是
。下列说法不正确的是![]()
![]()
已知:![]() 遇到
遇到![]() 会出现蓝色沉淀;
会出现蓝色沉淀; ![]()
A.![]()
B.原合金中铜的质量为![]()
C.若将上述![]() 稀硝酸逐滴加入到合金中,放出气体仍为
稀硝酸逐滴加入到合金中,放出气体仍为![]() 标准状况下
标准状况下![]()
D.d不是一确定值,可能为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡常数(25 ℃) | Ka=1.77 ×10-4 | Ka=4.0 ×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)在温度相同时,各弱酸的Ka值与酸性的相对强弱的关系为________________。
(2)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1 NaHCO3溶液的pH由大到小的关系为______________________。
(3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO![]() 、CO
、CO![]() 、HSO
、HSO![]() 、HCO
、HCO![]() 浓度从大到小的顺序为____________________________。
浓度从大到小的顺序为____________________________。
(4)下列离子方程式正确的是________(填字母)。
a.2ClO-+H2O+CO2=2HClO+CO![]()
b.2HCOOH+CO![]() =2HCOO-+H2O+CO2↑
=2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-=2HCOOH+SO![]()
d.Cl2+H2O+2CO![]() =2HCO
=2HCO![]() +Cl-+ClO-
+Cl-+ClO-
(5)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计下列实验(图中用于加热的仪器没有画出)制取Mg3N2,观察到装置A的黑色的固体变成红色,装置D的镁条变成白色,回答下列问题:
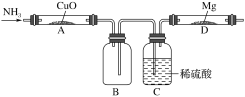
(1)装置A中生成的物质是纯净物,则可能是_________,证明的方法是_____________。
(2)设计C装置的作用是________________,缺陷是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示化合物X的说法错误的是
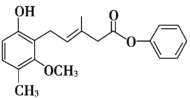
A.X的分子式是C20H20O
B.1 mol该化合物最多可以与3mol NaOH溶液反应
C.X能使酸性高锰酸钾溶液和溴水褪色
D.X在酸性下的两种水解产物都可以与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列酸碱溶液恰好完全中和,如图所示,则下列叙述正确的是( )
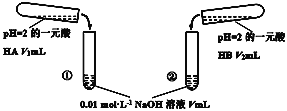
A.因为两种酸溶液的pH相等,故V1一定等于V2
B.若V1>V2,则说明HA为强酸,HB为弱酸
C.若实验①中,V=V1,则混合液中c(Na+)=c(A-)
D.实验②的混合溶液,可能有pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在容积为2 L的密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示。
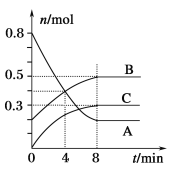
分析图中数据,回答下列问题:
(1)该反应的化学方程式为______________。
(2)反应开始至4 min时,物质A的平均反应速率为____。
(3)4 min时,正反应速率_______(填“>”“<”或“=”,下同)逆反应速率,8 min时,正反应速率________逆反应速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】位于短周期的四种元素A、B、C、D,其原子序数依次增大。A在周期表中原子半径最小;B是地壳中含量最高的元素;B、D位于同一主族;C的原子半径在同周期中最大。回答下列问题:
(1)写出由上述元素形成的具有漂白作用的3种物质的化学式:_________、_________、_________。
(2)写出含B元素质量分数最高的化合物的电子式:_____________。
(3)分别由A、B、C、D四种元素组成的两种化合物X和Y可以发生反应,试写出该反应的离子方程式:______________________。
(4)用电子式表示化合物C2B的形成过程:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com