
【题目】下列酸碱溶液恰好完全中和,如图所示,则下列叙述正确的是( )
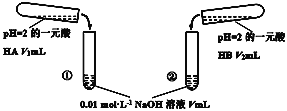
A.因为两种酸溶液的pH相等,故V1一定等于V2
B.若V1>V2,则说明HA为强酸,HB为弱酸
C.若实验①中,V=V1,则混合液中c(Na+)=c(A-)
D.实验②的混合溶液,可能有pH<7
【答案】C
【解析】
pH 均为2的一元酸HA、HB,两种溶液中H+离子浓度相等,酸越弱则酸的浓度越大,与氢氧化钠反应时消耗的体积越小,所以消耗的体积大的酸性较强;若V1>V2,则说明 HA 的酸性比HB的酸性强;若V1=V2,则说明 HA 的酸性与HB的酸性相同;
A.因为不知道两种酸的酸性强弱关系,所以不能判断V1与V2的相对大小,故A错误;
B.由以上分析可知,Vl>V2,则说明 HA 的酸性比HB的酸性强,但无法说明HA是强酸,故B错误;
C.若实验①中,V=V1,说明HA的物质的量浓度也为0.01mol/L,其pH=2,则HA为强酸,反应后溶液显中性,故混合液中c(Na+)=c(A-),故C正确;
D.完全反应后实验②的混合溶液中溶质为强碱弱酸盐或强酸强碱盐,溶液的pH≥7,不可能有pH<7,故D错误;
故答案为C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了为锂电池发展作出突出贡献的三位科学家。某废旧锂电池正极主要由LiFePO4、铝箔、炭黑等组成,Fe、Li、P具有极高的回收价值,具体流程如下:

(1)过程ⅰ生成NaAlO2溶液的离子方程式是__。
(2)过程ⅱ中HCl/H2O2的作用是__。
(3)浸出液X的主要成分为 Li+、Fe3+、H2PO4-等。过程ⅲ控制碳酸钠溶液浓度20%、温度85 ℃、反应时间3 h条件下,探究pH对磷酸铁沉淀的影响,如图所示。
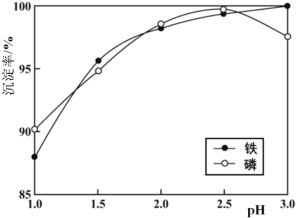
①综合考虑铁和磷沉淀率,最佳pH为__。
②结合平衡移动原理,解释过程ⅲ中pH增大,铁和磷沉淀率增大的原因__。
③当pH>2.5后,随pH增加,磷沉淀率出现了减小的趋势,解释其原因__。
(4)LiFePO4可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应制取,共沉淀反应的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给下列有机物命名:
(1) 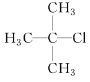 的系统命名为____________________________________。
的系统命名为____________________________________。
(2) 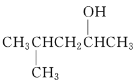 的系统命名为______________________________。
的系统命名为______________________________。
(3) 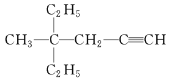 的系统命名为__________________________。
的系统命名为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaSO4在医疗上可作钡餐,高温煅烧BaSO4部分反应如下:
BaSO4(s)+4C(s) BaS(s)+4CO(g) ΔH=+571.2 kJ·mol-1
BaS(s)Ba(s)+S(s) ΔH=+460 kJ·mol-1
已知:2C(s)+O2(g)2CO(g) ΔH=-221 kJ·mol-1
则:Ba(s)+S(s)+2O2(g)BaSO4(s) ΔH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Rozerem用于治疗难以入睡型失眠症,是首个没有列为特殊管制的非成瘾失眠症治疗药物,合成该有机物过程中涉及如下转化,下列说法不正确的是( )
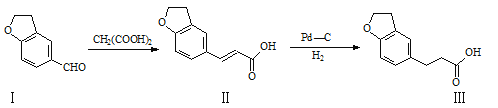
A.化合物Ⅰ、Ⅱ均能使酸性KMnO4溶液褪色
B.Ⅱ→Ⅲ的反应为加成反应
C.1mol化合物Ⅱ最多能与5molH2发生加成反应
D.与化合物Ⅰ互为同分异构体,且分子中含有2个醛基的芳香族化合物有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二碘(I2O5)可用作氧化剂,除去空气中的一氧化碳,易溶于水形成碘酸,不溶于无水乙醇、乙醚、氯仿和二硫化碳。用下列装置制备五氧化二碘(加热装置及夹持装置省略)。

制备五氧化二碘的步骤如下:
步骤1:I2与KClO3按一定比例加入反应器M中,用硝酸调节pH=1~2,温度控制在80~90℃,搅拌反应1h,使反应完全。
步骤2:然后冷却至室温,析出碘酸氢钾晶体。将过滤得到的晶体加水、加热溶解,并用足量氢氧化钾溶液中和至溶液pH为10。再冷却结晶,过滤得到的晶体于118℃干燥3h,得到碘酸钾产品。
步骤3:将步骤2制得的碘酸钾酸化后得碘酸(HIO3),再将碘酸在干燥空气气流中加热到200℃失水得到五氧化二碘。
(1)五氧化二碘可除去空气中的一氧化碳,反应生成碘单质,该反应中氧化剂与还原剂的物质的量之比为___。
(2)仪器M的名称是___。
(3)步骤1中除了生成碘酸氢钾[KH(IO3)2]外,同时还生成氯化钾和氯气,若n(KCl):n(C12)=5:3,写出该反应的化学方程式:___,该反应中的氧化剂是___(填化学式)。
(4)反扣的漏斗N除了可以防止倒吸,还有一个作用是____,NaOH溶液的作用是___。
(5)步骤2中的主要反应为KH(IO3)2+KOH===2KIO3+H2O,称取0.550g碘酸钾产品(假设杂质不参与反应),将产品放入烧杯中,加蒸馏水溶解,并加入足量酸化的KI溶液,配制成100mL溶液,取10.00mL配制的溶液于锥形瓶中并加入指示剂,然后用0.1mol·L-1 Na2S2O3标准溶液滴定至终点,三次实验平均消耗标准溶液的体积为15.00mL。(已知I2+2Na2S2O3=2NaI+Na2S4O6)
①该滴定选择的指示剂是_____。
②该碘酸钾产品中碘酸钾的质量分数是____%(保留三位有效数字)。
③若装Na2S2O3标准溶液的滴定管没有用Na2S2O3标准溶液润洗,则所测得产品的质量分数___(填“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列叙述的方法中,能将有机化合物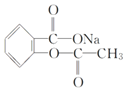 转变为
转变为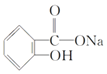 的有( )
的有( )
A.跟足量的NaOH溶液共热后,再通入二氧化碳直至过量
B.把溶液充分加热后,通入足量的二氧化硫
C.与稀H2SO4共热后,加入足量NaOH溶液
D.与稀H2SO4共热后,加入足量NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗硅提纯常见方法之一是先将粗硅与HCl反应制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g)。在2L密闭容器中,不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图。下列判断合理的是
Si(s)+3HCl(g)。在2L密闭容器中,不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图。下列判断合理的是
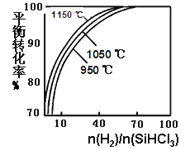
A. X是H2
B. 1150℃反应的平衡常数大于950℃时反应的平衡常数
C. 减小Si(s)的量,有利于提高SiHCl3的转化率
D. 工业上可采用增大压强的方法提高产率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com