
【题目】给下列有机物命名:
(1) 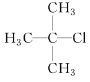 的系统命名为____________________________________。
的系统命名为____________________________________。
(2) 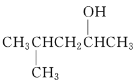 的系统命名为______________________________。
的系统命名为______________________________。
(3) 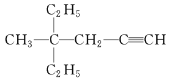 的系统命名为__________________________。
的系统命名为__________________________。
【答案】2-甲基-2-氯丙烷 4-甲基-2-戊醇 4-甲基-4-乙基-1-己炔
【解析】
(1) 的系统命名先写烷基位置和名称,再写卤代基团位置和名称,最后写某烷。
的系统命名先写烷基位置和名称,再写卤代基团位置和名称,最后写某烷。
(2)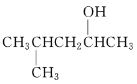 的系统命名先写烷基位置和名称,再写羟基位置和某醇。
的系统命名先写烷基位置和名称,再写羟基位置和某醇。
(3)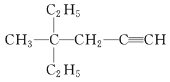 的系统命名先以含碳碳三键最长链为主链,离官能团最近一端开始编号,先简单基团,再复杂基团。
的系统命名先以含碳碳三键最长链为主链,离官能团最近一端开始编号,先简单基团,再复杂基团。
(1) 的系统命名先写烷基位置和名称,再写卤代基团位置和名称,最后写某烷,其命名为2-甲基-2-氯丙烷;故答案为:2-甲基-2-氯丙烷。
的系统命名先写烷基位置和名称,再写卤代基团位置和名称,最后写某烷,其命名为2-甲基-2-氯丙烷;故答案为:2-甲基-2-氯丙烷。
(2) 的系统命名先写烷基位置和名称,再写羟基位置和某醇,命名为4-甲基-2-戊醇;故答案为:4-甲基-2-戊醇。
的系统命名先写烷基位置和名称,再写羟基位置和某醇,命名为4-甲基-2-戊醇;故答案为:4-甲基-2-戊醇。
(3) 的系统命名先以含碳碳三键最长链为主链,离官能团最近一端开始编号,先简单基团,再复杂基团,命名为4-甲基-4-乙基-1-己炔;故答案为:4-甲基-4-乙基-1-己炔。
的系统命名先以含碳碳三键最长链为主链,离官能团最近一端开始编号,先简单基团,再复杂基团,命名为4-甲基-4-乙基-1-己炔;故答案为:4-甲基-4-乙基-1-己炔。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】含氰根(CN)的废水必须经处理后排放。某电镀废水pH≈12,氰化物以CN、Cu(CN)32等形式存在(均以CN计),处理流程如下:
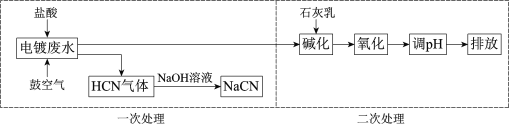
(1)HCN是一元弱酸,用离子方程式表示NaCN水溶液显碱性的原因:______。
(2)二次处理阶段,使用不同方法氧化。
①过硫酸钾(K2S2O8)氧化法:K2S2O8溶液将CN(N为-3价)氧化成毒性弱的CNO(N为-3价)。
Ⅰ.碱性溶液中S2O82在一定条件下氧化CN生成CNO和SO42的离子方程式是______。
Ⅱ.不同浓度的K2S2O8溶液对CN的去除率如图1。工业上选用浓度为1 mmol·L1
K2S2O8溶液,不用0.75 mmol·L1和2 mmol·L1的原因是______。
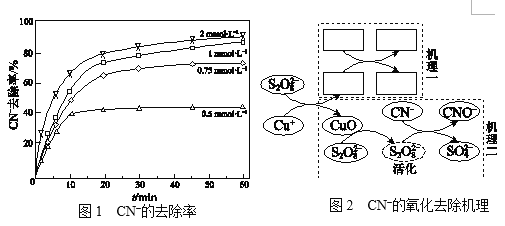
Ⅲ.研究CN的氧化去除机理。(文献中为碱性条件下的结论)
文献:a.没有Cu+,S2O82对CN没有去除效果。
b.S2O82和Cu+反应生成硫酸根自由基(SO4·)和CuO。
c.SO4·可能转变为羟基自由基(·OH)。
d.SO4· 、·OH均可将CN氧化为CNO。叔丁醇只可以使·OH失
去活性,乙醇可以使SO4· 、·OH均失去活性。
实验:相同条件下,向含Cu(CN)32的碱性废水中加入叔丁醇,CN的去除率没有影响;加入乙醇,CN的去除率降低50%。两种不同的CN的氧化去除机理如图2,结合文献和实验回答下列问题:
ⅰ.补全“机理一”_______________。
ⅱ.从“机理二”可看出CuO参与了去除CN,列举其证据:______。
②电解法:碱性环境中,在阳极发生两步反应,CN放电生成CNO,CNO再放电生成CO2和N2,第二步的阳极反应式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在20.00 mL 0.1000 mol·L-1 NH3·H2O溶液中逐滴滴加0.1000 mol·L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如图所示。下列说法正确的是

A. ①溶液:c(Cl-)>c(NH)>c(OH-)>c(H+)
B. ②溶液:c(NH)=c(Cl-)>c(OH-)=c(H+)
C. ①、②、③三点所示的溶液中水的电离程度②>③>①
D. 滴定过程中不可能出现:c(NH3·H2O)>c(NH)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡常数(25 ℃) | Ka=1.77 ×10-4 | Ka=4.0 ×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)在温度相同时,各弱酸的Ka值与酸性的相对强弱的关系为________________。
(2)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1 NaHCO3溶液的pH由大到小的关系为______________________。
(3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO![]() 、CO
、CO![]() 、HSO
、HSO![]() 、HCO
、HCO![]() 浓度从大到小的顺序为____________________________。
浓度从大到小的顺序为____________________________。
(4)下列离子方程式正确的是________(填字母)。
a.2ClO-+H2O+CO2=2HClO+CO![]()
b.2HCOOH+CO![]() =2HCOO-+H2O+CO2↑
=2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-=2HCOOH+SO![]()
d.Cl2+H2O+2CO![]() =2HCO
=2HCO![]() +Cl-+ClO-
+Cl-+ClO-
(5)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】mg铝镁合金与一定浓度的稀硝酸恰好完全反应(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加amol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值ng,则下列有关该实验的说法中正确的有
①沉淀中氢氧根的质量为(n-m)g
②恰好溶解后溶液中的NO3-离子的物质的量为aVmol
③反应过程中转移的电子的物质的量为![]() mol
mol
④生成NO气体的体积室温下为![]() L
L
⑤与合金反应的硝酸的物质的量为(![]() )mol
)mol
A. 2项 B. 3项 C. 4项 D. 5项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计下列实验(图中用于加热的仪器没有画出)制取Mg3N2,观察到装置A的黑色的固体变成红色,装置D的镁条变成白色,回答下列问题:
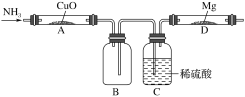
(1)装置A中生成的物质是纯净物,则可能是_________,证明的方法是_____________。
(2)设计C装置的作用是________________,缺陷是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列酸碱溶液恰好完全中和,如图所示,则下列叙述正确的是( )
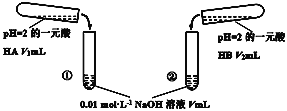
A.因为两种酸溶液的pH相等,故V1一定等于V2
B.若V1>V2,则说明HA为强酸,HB为弱酸
C.若实验①中,V=V1,则混合液中c(Na+)=c(A-)
D.实验②的混合溶液,可能有pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是芳香族化合物,其分子式为C9H11Cl,利用A合成2-甲基苯乙酸,其合成路线如下:
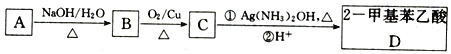
(1)A结构简式为_____________。
(2)A→B反应类型为_______;C中所含官能团的名称为______________。
(3)C→D第①步的化学方程式为____________。
(4)在NaOH醇溶液并加热的条件下,A转化为E,符合下列条件的E的同分异构体有___种,任写其中一种的结构简式____________。
i,苯环上仅有一个取代基;ii.能与溴水发生加成反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com