
【题目】含氰根(CN)的废水必须经处理后排放。某电镀废水pH≈12,氰化物以CN、Cu(CN)32等形式存在(均以CN计),处理流程如下:
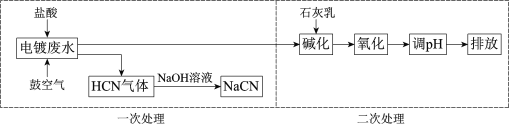
(1)HCN是一元弱酸,用离子方程式表示NaCN水溶液显碱性的原因:______。
(2)二次处理阶段,使用不同方法氧化。
①过硫酸钾(K2S2O8)氧化法:K2S2O8溶液将CN(N为-3价)氧化成毒性弱的CNO(N为-3价)。
Ⅰ.碱性溶液中S2O82在一定条件下氧化CN生成CNO和SO42的离子方程式是______。
Ⅱ.不同浓度的K2S2O8溶液对CN的去除率如图1。工业上选用浓度为1 mmol·L1
K2S2O8溶液,不用0.75 mmol·L1和2 mmol·L1的原因是______。
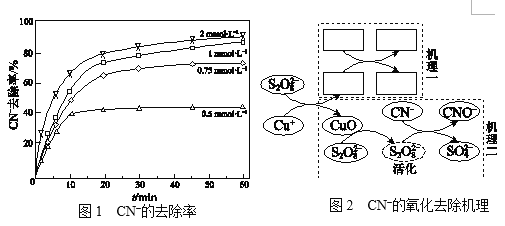
Ⅲ.研究CN的氧化去除机理。(文献中为碱性条件下的结论)
文献:a.没有Cu+,S2O82对CN没有去除效果。
b.S2O82和Cu+反应生成硫酸根自由基(SO4·)和CuO。
c.SO4·可能转变为羟基自由基(·OH)。
d.SO4· 、·OH均可将CN氧化为CNO。叔丁醇只可以使·OH失
去活性,乙醇可以使SO4· 、·OH均失去活性。
实验:相同条件下,向含Cu(CN)32的碱性废水中加入叔丁醇,CN的去除率没有影响;加入乙醇,CN的去除率降低50%。两种不同的CN的氧化去除机理如图2,结合文献和实验回答下列问题:
ⅰ.补全“机理一”_______________。
ⅱ.从“机理二”可看出CuO参与了去除CN,列举其证据:______。
②电解法:碱性环境中,在阳极发生两步反应,CN放电生成CNO,CNO再放电生成CO2和N2,第二步的阳极反应式是______。
【答案】![]()
![]()
![]()
![]() 1 mmol·L1比0.75 mmol·L1的反应速率快,CN的去除率高,比2 mmol·L1成本低 CN、CNO、SO4·、SO42(从左到右) 碱性条件下要有Cu+才能去除CN,而Cu+会生成CuO,加入乙醇,可以使SO4·失去活性,而CN-的去除率仍然有50%,说明CuO参与了去除CN
1 mmol·L1比0.75 mmol·L1的反应速率快,CN的去除率高,比2 mmol·L1成本低 CN、CNO、SO4·、SO42(从左到右) 碱性条件下要有Cu+才能去除CN,而Cu+会生成CuO,加入乙醇,可以使SO4·失去活性,而CN-的去除率仍然有50%,说明CuO参与了去除CN ![]()
【解析】
(1)CN水解显碱性;
(2)K2S2O8溶液将CN(N为-3价)氧化成毒性弱的CNO(N为-3价),
①根据氧化还原原理书写氧化还原方程式;由图1比较CN的去除率,考虑反应的速率和原料的经济性;由图2结合题目信息分析反应机理。
② 阳极第二步反应为CNO再放电生成CO2和N2, CNO中碳元素显+4价,氮元素显-3价。
(1)HCN是一元弱酸,NaCN会水解导致溶液显碱性,离子方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)①Ⅰ、碱性溶液中S2O82在一定条件下氧化CN生成CNO和SO42的离子方程式为:![]()
![]()
![]() ;
;
Ⅱ、由图1看出,选用浓度为1 mmol·L1K2S2O8溶液,既考虑了反应的速率和CN的转化率,也考虑了成本,故答案为:1 mmol·L1比0.75 mmol·L1的反应速率快,CN的去除率高,比2 mmol·L1成本低;
Ⅲ、ⅰ、结合文献资料(b)可知S2O82和Cu+反应生成硫酸根自由基(SO4·)和CuO,再结合总反应看,SO4·再与CN反应生成CNO和SO42,故图中机理一所填物质依次为:CN、CNO、SO4·、SO42(从左到右);故答案为:CN、CNO、SO4·、SO42(从左到右);
ⅱ、碱性条件下,没有Cu+,CN-不会被去除,而Cu+会生成CuO,加入乙醇,可以使SO4·失去活性,而CN-的去除率仍然有50%,说明CuO参与了去除CN;故答案为:碱性条件下要有Cu+才能去除CN,而Cu+会生成CuO,加入乙醇,可以使SO4·失去活性,而CN-的去除率仍然有50%,说明CuO参与了去除CN;
②阳极第二步反应为CNO再放电生成CO2和N2,电极反应式为:![]() 。
。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】已知二元酸H2A的电离方程式为:H2A=H++HA-,HA-![]() H++A2-,下列有关该酸及盐的说法正确的是
H++A2-,下列有关该酸及盐的说法正确的是
A.0.1 mol/LH2A溶液pH=1
B.H2A为强酸
C.NaHA溶液呈酸性的原因是:HA-+H2O![]() H2A+OH-
H2A+OH-
D.Na2A在溶液中不水解,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3。Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用。某科研小组用该原理处理污水,设计的装置如图所示。下列说法正确的是

A.为了增加污水的导电能力,应向污水中加入适量的H2SO4溶液
B.为了使燃料电池乙长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2
C.甲装置中Fe电极的反应为Fe-3e-=Fe3+
D.当乙装置中有1.6 g CH4参加反应时,C电极理论上生成气体的体积在标准状况下为4.48 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一个电解装置,该装置中X、Y分别为石墨电极,现分别在U型管中加入下列溶液进行电解,请回答有关问题:
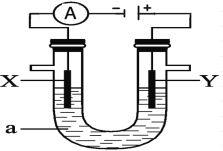
(1)若U型管中的液体a为饱和食盐水:在电极Y上产生的气体是_________ (填分子式),检验有该气体生成的简单方法是________________________;若该饱和食盐水中还含有少量的镁离子,则有可能在______极(选填“X”或“Y”)附近会首先生成白色不溶物;当电解产生0.2mol氢氧化钠时,能收集到标准状况下的氢气 ______升;工厂应用电解生成的氯气和氢气可以化合生成氯化氢,某工厂每天电解400t食盐,若生成的氯气80%用于生产盐酸,每天最多可生产31%的盐酸__________ t。(保留至整数)
(2)若U型管中的液体a为饱和氯化铜溶液:电极质量增加的是_______选填“X”或“Y”)极,该电极上发生______反应(选填“氧化”或“还原”);若要得到0.32克铜,理论上在电解过程中应转移_________mol电子;氯化铜溶液显酸性,原因是(用离子方程式表示)_______________________________;电解一段时间后,请你推测:整个溶液的酸性将如何变化(增强、减弱、不变,同时请写出理由:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100 mL FeBr2溶液中通入标准状况下2.24 L Cl2,溶液中有![]() 的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为( )
的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为( )
A.4 mol L-1B.![]() mol L-1C.
mol L-1C.![]() mol L-1D.
mol L-1D.![]() mol L-1
mol L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.mA(g)+nB(g) ![]() pC(g),平衡时A的浓度等于0.5mol·L-1 ,其它条件不变,将容器体积扩大一倍,达到新的平衡时A的浓度变为0.3mol·L-1 ,则化学计量数m+n<p
pC(g),平衡时A的浓度等于0.5mol·L-1 ,其它条件不变,将容器体积扩大一倍,达到新的平衡时A的浓度变为0.3mol·L-1 ,则化学计量数m+n<p
B.将一定量纯净的氨基甲酸铵置于密闭真空容器中,在恒定温度下使其分解平衡:NH2COONH4(s) ![]() 2NH3(g)+CO2(g),则CO2的体积分数不变能作为平衡判定依据
2NH3(g)+CO2(g),则CO2的体积分数不变能作为平衡判定依据
C.对于反应A(g)+B(g) ![]() 2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时给体系加压,则A的体积分数不变
2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时给体系加压,则A的体积分数不变
D.2NO(g)+2CO(g) ![]() N2+2CO2在常温下能够进行,则反应的△H <0
N2+2CO2在常温下能够进行,则反应的△H <0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与50 mL 0.1 mol·L-1的Na2CO3溶液中Na+的物质的量相同的溶液是( )
A.50 mL 0.2 mol·L-1的NaCl溶液B.100 mL 0.2 mol·L-1的NaCl溶液
C.25 mL 0.1 mol·L-1的Na2SO4溶液D.50 mL 0.1 mol·L-1的NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了为锂电池发展作出突出贡献的三位科学家。某废旧锂电池正极主要由LiFePO4、铝箔、炭黑等组成,Fe、Li、P具有极高的回收价值,具体流程如下:

(1)过程ⅰ生成NaAlO2溶液的离子方程式是__。
(2)过程ⅱ中HCl/H2O2的作用是__。
(3)浸出液X的主要成分为 Li+、Fe3+、H2PO4-等。过程ⅲ控制碳酸钠溶液浓度20%、温度85 ℃、反应时间3 h条件下,探究pH对磷酸铁沉淀的影响,如图所示。
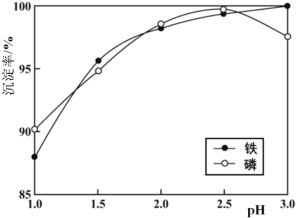
①综合考虑铁和磷沉淀率,最佳pH为__。
②结合平衡移动原理,解释过程ⅲ中pH增大,铁和磷沉淀率增大的原因__。
③当pH>2.5后,随pH增加,磷沉淀率出现了减小的趋势,解释其原因__。
(4)LiFePO4可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应制取,共沉淀反应的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给下列有机物命名:
(1) 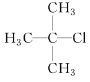 的系统命名为____________________________________。
的系统命名为____________________________________。
(2) 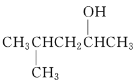 的系统命名为______________________________。
的系统命名为______________________________。
(3) 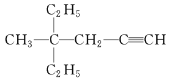 的系统命名为__________________________。
的系统命名为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com