
����Ŀ����ҵ�ϲ��õ�һ����ˮ�����������£�������ˮ��pH��5.0��6.0֮�䣬ͨ���������Fe(OH)3��Fe(OH)3���������ԣ�����������������������о���ˮ�����á�ij����С���ø�ԭ��������ˮ����Ƶ�װ����ͼ��ʾ������˵����ȷ����

A.Ϊ��������ˮ�ĵ���������Ӧ����ˮ�м���������H2SO4��Һ
B.Ϊ��ʹȼ�ϵ���ҳ�ʱ���ȶ����У���صĵ�������Ӧ�����ȶ�����ع���ʱ��ѭ��������AΪCO2
C.��װ����Fe�缫�ķ�ӦΪFe-3e-=Fe3+
D.����װ������1.6 g CH4�μӷ�Ӧʱ��C�缫�������������������ڱ�״����Ϊ4.48 L
���𰸡�B
��������
��װ��Ϊ���أ���װ��Ϊԭ��أ�ԭ��ع���ʱ��ͨ������һ��Ϊ����������������Ӧ�������缫��Ӧ��CH4+4CO32--8e-=5CO2+2H2O��ͨ��������һ��Ϊ������������ԭ��Ӧ��������ӦΪO2+2CO2+4e-=2CO32-���ڵ����У�Fe�缫Ϊ������������Ӧ��Fe-2e-=Fe2+��C�缫Ϊ�����������ĵ缫��ӦΪ��2H++2e-=H2�������������Ӿ��л�ԭ�ԣ��ܱ����������������ۣ�4Fe2++10H2O+O2=4Fe(OH)3��+8H+���Դ˽����⡣
A. ������ˮ��pH��5.0��6.0֮�䣬ͨ���������Fe(OH)3����ʱ��Ϊʹ����������ǿ�ɼ��������ˮ�ġ������Ե��Σ���Ϊ�������������Fe(OH)3������A����
B. �����������̼����Ϊ����ʣ�������ӦʽΪ��CH4+4CO32--8e-=5CO2+2H2O��������ӦΪO2+2CO2+4e-=2CO32-������ѭ�����õ�����A��CO2��B��ȷ��
C. ������Fe����������Fe-2e-=Fe2+��C����
D. ����װ������1.6 g CH4�μӷ�Ӧʱ��1.6 g��������ʵ�����0.1mol�����ݵ缫��ӦʽCH4+4CO32--8e-=5CO2+2H2O��֪��0.1 mol����μӷ�Ӧʱ����0.8 mol����ת�ƣ�����C�缫�ĵ缫��ӦΪ��2H++2e-=H2���������ͬһ�պϻ�·�е���ת����Ŀ��ȣ���֪C�缫�����������������ڱ�״����V(H2)=0.4 mol��22.4 L/mol=8.96 L��D����
�ʺ���ѡ����B��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ѡ���(��2����)��Ԫ������Դ�����ϵ�����Ӧ�ù㷺���ش��������⣺
������ͬ���ڵ����и���Ԫ�صĻ�̬ԭ���У��������������̬��ԭ����ͬ��Ԫ����________�֡���̬Ti2+�����������Ų�ʽΪ________________��
����������������Ϊ��I1=580 kJmol-1��I2=1820 kJmol-1��I3=2750 kJmol-1��I4=11600 kJmol-1����������ݹ��ɣ�Ԥ�Ⱶ�������ܵĵ�һ��������ͻԾ���������________֮��(��I1��I2��I3�����![]() ��
��
����֪����A��Ԫ�ص�̼����MCO3�ȷֽ����Ҫ�����ǣ�M2+���̼��������е������ӡ���CaCO3��BaCO3�ķֽ��¶Ƚϸߵ���________________(�ѧʽ)��������________________��
�ȴ���M�ܴ���ϩ����ϩ������ϩ�ȵľۺϣ���ṹ��ͼ1��ʾ��
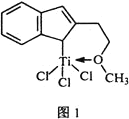
��M�У�̼ԭ�ӵ��ӻ�������________________��
��M������________![]() ����
����![]() ��
��
A. ���� B. ���� C. ��λ�� D.��� E. ���Ӽ�
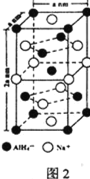
���⻯����(NaAlH4)��һ���������ʴ�����ϣ��侧���ṹ��ͼ2��ʾ��Ϊ�����塣д����AlH4���ռ乹����ͬ��һ�ַ���_______________(�ѧʽ)��NaAlH4�����У���AlH4�������ҵȾ��Na+��________����NaAlH4������ܶ�Ϊ________ gcm-3(�ú�a��NA�Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.���������Ҫ���ܵ�ȼ�ϣ���������N2O4��N2H4��Ϊȼ�ϣ���ҵ������N2��H2���Ժϳ�NH3��NH3�ֿ��Խ�һ���Ʊ�����(N2H4)�ȡ���֪��
N2(g) + 2O2(g)��2NO2(g) ��H= +67.7kJ��mol��1
N2H4(g) + O2(g)��N2(g) + 2H2O(g) ��H=��534.0kJ��mol��1
NO2(g)![]() 1/2N2O4(g) ��H=��26.35kJ��mol��1
1/2N2O4(g) ��H=��26.35kJ��mol��1
��д����̬��������̬������������ȼ�����ɵ�������̬ˮ���Ȼ�ѧ����ʽ��___��
��.1100��ʱ�����Ϊ2L�ĺ��������з������·�Ӧ��Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g)��
Na2S(s)+4H2O(g)��
��1���������жϷ�Ӧ�ﵽƽ��״̬����____��
A��������ѹǿ���� B����������ܶȲ���
C��1molH-H������ͬʱ�γ�2 mol H-O D��H2�������������
��2����2minʱ��Ӧ��ƽ�⣬��ʱ������������8g������H2��ʾ�÷�Ӧ�ķ�Ӧ����Ϊ___��
��3��ij�¶��¸÷�Ӧ��ƽ��״̬����û�������ƽ����Է�������Ϊ14������¶��µ�ƽ�ⳣ��KΪ_____��
��4������Ӧ��ƽ�����������H2���ٴ�ƽ���H2O���������___(����������������С������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʯ����Ҫ�ɷ�ΪBaCO3(��Ca2+��Mg2+��Fe3+������)��ʵ�������ö���ʯ�Ʊ�BaCl2��2H2O��������ͼ��
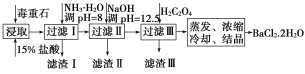
��1������ʯ�������ȡǰ������ĥ��Ŀ����__��
��2������NH3��H2O��pH=8�ɳ�ȥ__(�����ӷ���)���������к�__(�ѧʽ)������H2C2O4ʱӦ���������ԭ����__��
��֪��Ksp(BaC2O4)=1.6��10-7��Ksp(CaC2O4)=2.3��10-9
Ca2+ | Mg2+ | Fe3+ | |
��ʼ����ʱ��pH | 11.9 | 9.1 | 1.9 |
��ȫ����ʱ��pH | 13.9 | 11.1 | 3.2 |
��3�����ü�����ζ����ɲⶨBa2+�ĺ�����ʵ����������С�
��֪��2CrO42-+2H+=Cr2O72-+H2O
Ba2++CrO42-=BaCrO4��
�������ȡxmLһ��Ũ�ȵ�Na2CrO4��Һ����ƿ�У��������ָʾ������bmol��L-1�����Һ�ζ����յ㣬��õμ���������ΪV0mL��
�������ȡymLBaCl2��Һ����ƿ�У�����xmL�벽�����ͬŨ�ȵ�Na2CrO4��Һ����Ba2+��ȫ�������ټ������ָʾ������bmol��L-1�����Һ�ζ����յ㣬��õμ���������ΪV1mL��
�μ������ҺʱӦʹ����ʽ�ζ��ܣ���0���̶�λ�ڵζ��ܵ�__(�����Ϸ��������·���)��BaCl2��Һ��Ũ��Ϊ__mol��L-1����������еμ�����ʱ����������Һ������Ba2+Ũ�Ȳ���ֵ��__(����ƫ��������ƫС��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T��ʱ����6molCO2��8molH2����2L�ܱ������У�������ӦCO2��g��+3H2��g��![]() CH3OH��g��+H2O��g����������H2�����ʵ�����ʱ��仯��ͼ��ʵ����ʾ��ͼ�����߱�ʾ���ı�ijһ��Ӧ����ʱ��H2�����ʵ�����ʱ��ı仯������˵����ȷ���ǣ�������
CH3OH��g��+H2O��g����������H2�����ʵ�����ʱ��仯��ͼ��ʵ����ʾ��ͼ�����߱�ʾ���ı�ijһ��Ӧ����ʱ��H2�����ʵ�����ʱ��ı仯������˵����ȷ���ǣ�������
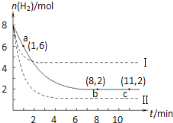
A.���ߢ��Ӧ�������ı��ǽ���ѹǿ
B.�����ߢ��Ӧ�������ı������£���÷�Ӧ��H��0
C.��Ӧ��ʼ��a��ʱv��H2��=1mol��L-1��min-1
D.T��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ0.125
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��PET��![]() ��M����= 192 g��mol1�������������ϳ���ά�����ϡ���ijPET��Ʒ�Ķ˻����Ȼ������ʵ�����������ƽ���ۺ϶ȣ��Է�̪��ָʾ������c mol��L1 NaOH����Һ�ζ�m g PET�˻��е��Ȼ����յ㣨������ˮ��Һ��ͬ��������NaOH����Һv mL������˵������ȷ����
��M����= 192 g��mol1�������������ϳ���ά�����ϡ���ijPET��Ʒ�Ķ˻����Ȼ������ʵ�����������ƽ���ۺ϶ȣ��Է�̪��ָʾ������c mol��L1 NaOH����Һ�ζ�m g PET�˻��е��Ȼ����յ㣨������ˮ��Һ��ͬ��������NaOH����Һv mL������˵������ȷ����
A.PET������һ�ֿɽ���߷��Ӳ���
B.�ζ��յ�ʱ����Һ��Ϊdz��ɫ
C.�ϳ�PET��һ�ֵ������Ҵ���ͬϵ��
D.PET��ƽ���ۺ϶�![]() �����Զ˻���Ħ��������
�����Զ˻���Ħ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Һ��п�����һ�ֵ�ѹ�ϸߵĶ��ε�أ����гɱ��͡���ȫ��ǿ����ѭ��ʹ�õ��ص㣬��ʾ��ͼ����ͼ������˵������ȷ����
��֪����Zn(OH)2+2OH == Zn(OH)42 �� ��KOH�������������Ӵ��ڡ����ɻ�Ǩ�ơ�
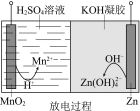
A.�ŵ�����У�H+��������Ǩ��
B.�ŵ�����У������ĵ缫��Ӧ��MnO2+4H++2e== Mn2++2H2O
C.�������У������ĵ缫��Ӧ��Zn(OH)42+2e == Zn+4OH
D.�������У������е�KOH������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������CN���ķ�ˮ���뾭�������ŷš�ij��Ʒ�ˮpH��12���軯����CN��Cu(CN)32����ʽ���ڣ�����CN�ƣ��������������£�
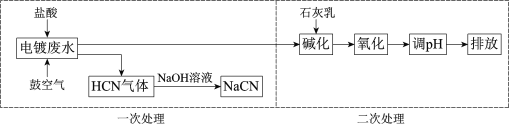
(1)HCN��һԪ���ᣬ�����ӷ���ʽ��ʾNaCNˮ��Һ�Լ��Ե�ԭ��______��
(2)���δ����Σ�ʹ�ò�ͬ����������
��������أ�K2S2O8����������K2S2O8��Һ��CN��NΪ��3�ۣ������ɶ�������CNO��NΪ��3�ۣ���
������Һ��S2O82��һ������������CN����CNO��SO42�����ӷ���ʽ��______��
��ͬŨ�ȵ�K2S2O8��Һ��CN��ȥ������ͼ1����ҵ��ѡ��Ũ��Ϊ1 mmol��L1
K2S2O8��Һ������0.75 mmol��L1��2 mmol��L1��ԭ����______��
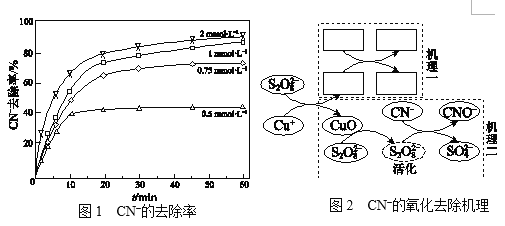
���о�CN������ȥ����������������Ϊ���������µĽ��ۣ�
���ף�a��û��Cu+��S2O82��CNû��ȥ��Ч����
b��S2O82��Cu+��Ӧ������������ɻ���SO4������CuO��
c��SO4������ת��Ϊ�ǻ����ɻ�����OH����
d��SO4�� ����OH���ɽ�CN����ΪCNO���嶡��ֻ����ʹ��OHʧ
ȥ���ԣ��Ҵ�����ʹSO4�� ����OH��ʧȥ���ԡ�
ʵ�飺��ͬ�����£���Cu(CN)32�ļ��Է�ˮ�м����嶡����CN��ȥ����û��Ӱ�죻�����Ҵ���CN��ȥ���ʽ���50%�����ֲ�ͬ��CN������ȥ��������ͼ2�����������ʵ���ش��������⣺
������ȫ������һ��_______________��
�����ӡ����������ɿ���CuO������ȥ��CN���о���֤�ݣ�______��
�ڵ�ⷨ�����Ի����У�����������������Ӧ��CN�ŵ�����CNO��CNO�ٷŵ�����CO2��N2���ڶ�����������Ӧʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20.00 mL 0.1000 mol��L��1 NH3��H2O��Һ����εμ�0.1000 mol��L��1 HCl��Һ����ҺpH�����HCl��Һ����ı仯������ͼ��ʾ������˵����ȷ����

A. ����Һ��c(Cl��)>c(NH)>c(OH��)>c(H��)
B. ����Һ��c(NH)��c(Cl��)>c(OH��)��c(H��)
C. ����������������ʾ����Һ��ˮ�ĵ���̶Ȣ�>��>��
D. �ζ������в����ܳ��֣�c(NH3��H2O)>c(NH)>c(OH��)>c(Cl��)>c(H��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com