
【题目】毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质)。实验室利用毒重石制备BaCl2·2H2O的流程如图:
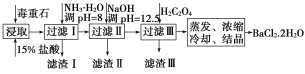
(1)毒重石用盐酸浸取前需充分研磨,目的是__。
(2)加入NH3·H2O调pH=8可除去__(填离子符号),滤渣Ⅱ中含__(填化学式)。加入H2C2O4时应避免过量,原因是__。
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+=Cr2O72-+H2O
Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取xmL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V0mL。
步骤Ⅱ:移取ymLBaCl2溶液于锥形瓶中,加入xmL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的__(填“上方”或“下方”)。BaCl2溶液的浓度为__mol·L-1。若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将__(填“偏大”或“偏小”)。
【答案】增大接触面积从而使反应速率加快 Fe3+ Mg(OH)2、Ca(OH)2 H2C2O4过量会导致生成BaC2O4沉淀,产品产量减少 上方 ![]() 偏大
偏大
【解析】
制备BaCl2·2H2O的流程:毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),加盐酸溶解,碳酸钡和盐酸反应:BaCO3+2H+=Ba2++CO2↑+H2O,加入氨水,调pH为8,Fe3+完全沉淀时的pH为3.2,只有Fe3+完全沉淀,滤渣1为Fe(OH)3,溶液中主要含Ca2+、Mg2+、Ba2+,加入氢氧化钠调节pH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;溶液中主要含Ca2+、Ba2+,加入H2C2O4,得到CaC2O4↓,除去Ca2+,蒸发浓缩冷却结晶得到BaCl2·2H2O。
(1)化学反应的速率与反应物的接触面积有关,毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快。故答案为:增大接触面积从而使反应速率加快;
(2)根据流程图和表中数据可知:Fe3+完全沉淀时的pH为3.2,加入氨水,调pH为8,Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+,Fe3+完全沉淀,滤渣1为Fe(OH)3,加入氢氧化钠调节pH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2,溶液中主要含Ca2+、Ba2+,Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9,易形成CaC2O4沉淀,加入H2C2O4时应避免过量,防止CaC2O4沉淀完全后,过量的H2C2O4会导致生成BaC2O4沉淀,产品的产量减少;
故答案为:Fe3+;Mg(OH)2、Ca(OH)2;H2C2O4过量会导致生成BaC2O4沉淀,产品产量减少;
(3)滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的上方;
步骤Ⅱ:待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL,则发生2CrO42-+2H+═Cr2O72-+H2O的盐酸的物质的量为:V1×10-3×bmol,步骤Ⅰ:用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL,加入的总盐酸的物质的量:V0×10-3×bmol,Ba2++CrO42-═BaCrO4↓,与Ba2+反应的CrO42-的物质的量为V0×10-3×bmol-V1×10-3×bmol=(V0-V1)b×10-3mol,步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,所以BaCl2溶液的浓度为:![]() mol·L-1=
mol·L-1=![]() mol·L-1。若步骤Ⅱ中滴加盐酸时有少量待测液溅出,V1减小,Ba2+浓度测量值将偏大。故答案为:上方;
mol·L-1。若步骤Ⅱ中滴加盐酸时有少量待测液溅出,V1减小,Ba2+浓度测量值将偏大。故答案为:上方;![]() ;偏大。
;偏大。


科目:高中化学 来源: 题型:
【题目】R元素的一种原子可表示为:![]() ,则下列说法中正确的是
,则下列说法中正确的是
A.R元素的相对原子质量的近似整数值在数值上等于A
B.R元素的近似相对原子质量为A
C.R元素的近似相对原子质量为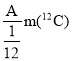 (其中m(
(其中m(![]() )表示一个碳-12原子的质量)
)表示一个碳-12原子的质量)
D.无法计算出R元素的近似相对原子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二元酸H2A的电离方程式为:H2A=H++HA-,HA-![]() H++A2-,下列有关该酸及盐的说法正确的是
H++A2-,下列有关该酸及盐的说法正确的是
A.0.1 mol/LH2A溶液pH=1
B.H2A为强酸
C.NaHA溶液呈酸性的原因是:HA-+H2O![]() H2A+OH-
H2A+OH-
D.Na2A在溶液中不水解,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物Z可用于治疗哮喘、系统性红斑狼疮等,可由X(咖啡酸)和Y(1,4
-环己二酮单乙二醇缩酮)为原料合成(如下图)。
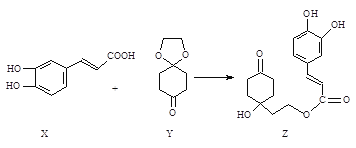
试填空:
(1)X的分子式为_______;该分子中最多共面的碳原子数为________。
(2)Y中是否含有手性碳原子_____(填“是”或“否”)。
(3)Z能发生_______反应。(填序号)
A.取代反应 B.消去反应 C.加成反应
(4)1 mol Z与足量的氢氧化钠溶液充分反应,需要消耗氢氧化钠________mol;
1 mol Z在一定条件下与足量H2充分反应,需要消耗H2 ________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.1 mol O2的体积是22.4 L
B.1.7 g NH3中含有的质子数约为6.02×1023
C.8 g S在足量O2中完全燃烧转移的电子数约为3.01×1023
D.0.5 mol·L1NaCl溶液中含有Cl的物质的量为0.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是 ( )
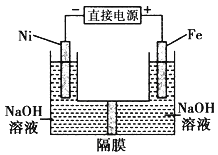
A.铁是阳极,电极反应为 Fe-6e一+4H2O=FeO42-+ 8H+
B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C.若隔膜为阴离子交换膜, 则电解结束后左侧溶液中含有FeO42-
D.电解时阳极区pH 降低、阴极区 pH升高,撤去隔膜混合后,与原溶液比较 pH升高(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3。Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用。某科研小组用该原理处理污水,设计的装置如图所示。下列说法正确的是

A.为了增加污水的导电能力,应向污水中加入适量的H2SO4溶液
B.为了使燃料电池乙长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2
C.甲装置中Fe电极的反应为Fe-3e-=Fe3+
D.当乙装置中有1.6 g CH4参加反应时,C电极理论上生成气体的体积在标准状况下为4.48 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一个电解装置,该装置中X、Y分别为石墨电极,现分别在U型管中加入下列溶液进行电解,请回答有关问题:
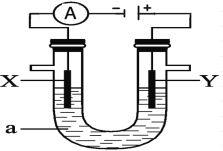
(1)若U型管中的液体a为饱和食盐水:在电极Y上产生的气体是_________ (填分子式),检验有该气体生成的简单方法是________________________;若该饱和食盐水中还含有少量的镁离子,则有可能在______极(选填“X”或“Y”)附近会首先生成白色不溶物;当电解产生0.2mol氢氧化钠时,能收集到标准状况下的氢气 ______升;工厂应用电解生成的氯气和氢气可以化合生成氯化氢,某工厂每天电解400t食盐,若生成的氯气80%用于生产盐酸,每天最多可生产31%的盐酸__________ t。(保留至整数)
(2)若U型管中的液体a为饱和氯化铜溶液:电极质量增加的是_______选填“X”或“Y”)极,该电极上发生______反应(选填“氧化”或“还原”);若要得到0.32克铜,理论上在电解过程中应转移_________mol电子;氯化铜溶液显酸性,原因是(用离子方程式表示)_______________________________;电解一段时间后,请你推测:整个溶液的酸性将如何变化(增强、减弱、不变,同时请写出理由:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了为锂电池发展作出突出贡献的三位科学家。某废旧锂电池正极主要由LiFePO4、铝箔、炭黑等组成,Fe、Li、P具有极高的回收价值,具体流程如下:

(1)过程ⅰ生成NaAlO2溶液的离子方程式是__。
(2)过程ⅱ中HCl/H2O2的作用是__。
(3)浸出液X的主要成分为 Li+、Fe3+、H2PO4-等。过程ⅲ控制碳酸钠溶液浓度20%、温度85 ℃、反应时间3 h条件下,探究pH对磷酸铁沉淀的影响,如图所示。
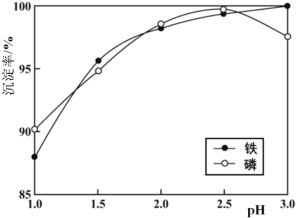
①综合考虑铁和磷沉淀率,最佳pH为__。
②结合平衡移动原理,解释过程ⅲ中pH增大,铁和磷沉淀率增大的原因__。
③当pH>2.5后,随pH增加,磷沉淀率出现了减小的趋势,解释其原因__。
(4)LiFePO4可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应制取,共沉淀反应的化学方程式为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com